Auteurs
Jin B, Hu W, Su S, Xu H, Lu X,
Chanté X
,
Yang H
,
Mao Y
,
Du S
A reçu
28 avril 2021
Accepté pour publication
26 juillet 2021
Publié
10 août 2021Volume 2021:13 Pages 6263—6277
EST CE QUE JE
https://doi.org/10.2147/CMAR.S317954
Vérifié pour plagiat
Oui
Examen par
Examen par les pairs anonyme unique
Commentaires des pairs évaluateurs
3
Éditeur ayant approuvé la publication :
Dr Beicheng Sun
Télécharger l'article
[PDF]
Bao Jin,
1,
*
Wenmo Hu,
2,
*
Si Su,
2,
*
Haifeng Xu,
1
Xin Lu,
1
Xinting Sang,
1
Huayu Yang,
1
Yilei Mao,
1
Shunda Du
1
1
Département de chirurgie du foie, Peking Union Medical College Hospital (PUMCH), Peking Union Medical College (PUMC) et Académie chinoise des sciences médicales (CAMS), Pékin, 100730, République populaire de Chine ;
2
Peking Union Medical College (PUMC) & Chinese Academy of Medical Sciences (CAMS), Pékin, 100730, République populaire de Chine*Ces auteurs ont contribué à parts égales à ce travail. Correspondance : Shunda Du ; Yilei MaoDépartement de chirurgie du foie, Hôpital du Collège médical de l'Union de Pékin (PUMC), PUMC et Académie chinoise des sciences médicales, Pékin, 100730, République populaire de ChineEmail
[email protégé]
;
[email protégé]
But:
Nous avons déterminé la valeur pronostique de l'indice de réponse inflammatoire systémique (SIRI) chez les patients atteints de cholangiocarcinome après chirurgie et construit un modèle de prédiction de survie basé sur SIRI.
Patients et méthodes:
Nous avons recruté 328 patients atteints de cholangiocarcinome confirmé histopathologiquement de 2003 à 2017 et avons effectué des analyses de survie de Kaplan-Meier et de Cox pour analyser la valeur pronostique du SIRI et identifier d'autres facteurs importants. Un nomogramme impliquant SIRI et d'autres facteurs clinicopathologiques a été établi sur la base de la cohorte de formation. L'indice de concordance (C-index), l'analyse de la courbe de décision, les tracés d'étalonnage et le test de Hosmer-Lemeshow ont été utilisés pour évaluer l'utilité clinique du nomogramme et pour le comparer avec le système de classification TNM traditionnel. Les résultats ont été validés à l'aide d'une cohorte de validation distincte.
Résultats:
Les patients ont été répartis au hasard dans les cohortes d'entraînement (n = 232) et de validation (n = 96). Dans la cohorte d'entraînement, les facteurs indépendants dérivés de l'analyse multivariée de Cox étaient le SIRI, le rapport plaquettes/lymphocytes, la jaunisse, le niveau de γ-glutamyl transpeptidase, la taille maximale de la tumeur, le stade N, le stade M et la chirurgie radicale. Les courbes des caractéristiques de fonctionnement du récepteur (ROC) dépendantes du temps ont montré une AUC plus élevée pour SIRI que celles pour d'autres biomarqueurs basés sur l'inflammation. Un nomogramme contenant tous les facteurs indépendants a montré une bonne discrimination et un bon étalonnage. Les valeurs de l'indice C pour la survie globale, 0,737 (Cl à 95 % : 0,683–0,791) et 0,738 (Cl à 95 % : 0,679–0,797) dans les cohortes d'entraînement et de validation, respectivement, étaient significativement meilleures que celles du système de classification TNM [ 0,576 (IC à 95 % : 0,515–0,637) et 0,523 (Cl à 95 % : 0,465–0,581), respectivement].
Conclusion:
Le SIRI était un facteur pronostique indépendant du cholangiocarcinome. Un modèle pronostique basé sur SIRI pourrait aider les cliniciens à stratifier les patients plus précisément et à fournir un traitement individualisé.
Mots clés:
indice de réponse inflammatoire systémique, cholangiocarcinome, pronostic, nomogramme, survie
introduction
Le cholangiocarcinome, deuxième tumeur maligne hépatobiliaire la plus fréquente après le carcinome hépatocellulaire,
1
provient de l'épithélium des voies biliaires et peut impliquer n'importe quelle partie de l'arbre biliaire.
2
L'incidence du cholangiocarcinome aurait augmenté ces dernières années,
3
,
4
avec des taux ajustés en fonction de l'âge entre 2,1 pour 100 000 dans les populations noires et non hispaniques et 2,8 à 3,3 pour 100 000 chez les Asiatiques et les hispaniques.
1
Étant donné que la plupart des patients au stade précoce sont asymptomatiques, une grande proportion a une maladie à un stade avancé lors de la présentation. Par conséquent, seulement environ 35 % des patients à un stade précoce ont la possibilité de subir une résection chirurgicale à visée curative.
5
Par ailleurs, près de 30 % des patients jugés résécables aux examens d'imagerie initiaux ne sont pas résécables à l'exploration, ce qui entraîne des marges positives dans les rapports de pathologie finaux.
6
Tous ces facteurs contribuent au mauvais pronostic des patients atteints de cholangiocarcinome, et la mortalité est parallèle à son taux d'incidence (environ 1,0 pour 100 000).
7
,
8
Ainsi, une prédiction précise de l'évolution des patients atteints de cholangiocarcinome est nécessaire de toute urgence. Le système de stadification TNM est actuellement la norme la plus largement utilisée pour la stadification du cancer. Néanmoins, d'autres facteurs clinicopathologiques pourraient également jouer un rôle crucial dans l'évolution des patients atteints de cholangiocarcinome, entraînant une hétérogénéité considérable du pronostic clinique chez les patients du même stade. Par conséquent, des modèles pronostiques plus précis pour le cholangiocarcinome sont nécessaires de toute urgence dans le cadre clinique.
Il est largement reconnu que la réponse inflammatoire est un facteur important dans le développement et la progression du cancer.
9
Des informations sur certaines cellules immunitaires-inflammatoires, telles que les neutrophiles, les monocytes, les plaquettes et les lymphocytes, peuvent être facilement acquises en effectuant une numération globulaire complète. Sur cette base, des biomarqueurs basés sur l'inflammation, notamment le rapport neutrophiles/lymphocytes (NLR), le rapport monocytes/lymphocytes (MLR) et le rapport plaquettes/lymphocytes (PLR) ont été étudiés, et leur valeur pronostique dans le cholangiocarcinome a été étudiée. été illustré.
dix
,
11
Récemment, Qi et al ont proposé un biomarqueur innovant basé sur l'inflammation intégrant le nombre périphérique de neutrophiles, de monocytes et de lymphocytes, à savoir l'indice de réponse systémique à l'inflammation (SIRI).
12
Des études ultérieures ont rapporté la capacité pronostique de SIRI dans les tumeurs solides, telles que les cancers de l'œsophage, de l'estomac, du pancréas et du nasopharynx.
13-15
Cependant, il y a encore un manque de preuves montrant si SIRI peut être un indicateur pronostique pour prédire l'issue des patients atteints de cholangiocarcinome. De plus, à notre connaissance, il n'existe toujours pas de modèle pronostique incluant des biomarqueurs basés sur l'inflammation pour le cholangiocarcinome.
Par conséquent, notre recherche visait à étudier la valeur pronostique du SIRI en utilisant une cohorte de patients atteints de cholangiocarcinome après résection chirurgicale, et à construire un modèle pronostique intégrant le SIRI dans une cohorte d'entraînement et tester sa précision prédictive dans une cohorte de validation.
Patients et méthodes
Les patients
Du 1er janvier 2003 au 31 décembre 2017, les patients ayant bénéficié d'un traitement chirurgical dans notre établissement et dont le rapport anatomopathologique révélait un cholangiocarcinome ont été recrutés rétrospectivement pour cette étude.
Les critères d'inclusion de l'étude étaient : (1) le cholangiocarcinome comme diagnostic principal, qui a été confirmé par un examen histopathologique, (2) la chirurgie réalisée pour le cholangiocarcinome, (3) les résultats des tests sanguins de routine mesurés dans les sept jours avant la chirurgie étaient disponibles, et ( 4) les données de suivi postopératoire et les informations clinicopathologiques étaient complètes et disponibles.
Les critères d'exclusion de l'étude étaient : (1) l'absence de diagnostic histopathologique définitif du cholangiocarcinome, (2) l'absence d'informations clinicopathologiques, (3) des données de suivi incomplètes et (4) la présence comorbide d'autres tumeurs malignes.
Après sélection, les 328 patients qui ont ensuite été recrutés répondaient aux critères d'inclusion. L'ensemble de la cohorte a été divisé au hasard en cohortes d'entraînement et de validation dans un rapport de 7 : 3 en utilisant le package « caret » de la version R 3.6.2.
Déclaration d'éthique
Cette étude a été approuvée par l'Institutional Review Board du Peking Union Medical College Hospital (PUMCH) (n° : S-K1110). Le consentement éclairé a été obtenu de tous les patients selon le règlement de la Commission. L'étude a été réalisée conformément aux normes éthiques de la Déclaration d'Helsinki.
16
Collecte de données
Les dossiers médicaux connexes ont été examinés manuellement pour obtenir des informations démographiques et cliniques. Nous avons collecté les informations démographiques des patients, les symptômes cliniques, les résultats des tests sériques, les rapports chirurgicaux et les résultats histopathologiques. Les biomarqueurs inflammatoires, y compris le SIRI, le NLR, le MLR et le PLR, ont été définis comme suit : SIRI = N*M/L, NLR=N/L, MLR=M/L et PLR = P/L, où N, M , L et P se réfèrent aux comptes périphériques des neutrophiles, des monocytes, des lymphocytes et des plaquettes, respectivement. La 7e édition du système de classification AJCC TNM a été utilisée pour déterminer les stades TNM cliniques et postopératoires pathologiques préopératoires.
17
Les marges d'incision et la taille maximale de la tumeur ont été déterminées sur la base des rapports histopathologiques finaux. La chirurgie radicale a été définie comme l'exigence de protocoles chirurgicaux radicaux avec des marges d'incision microscopiquement négatives. Tous les patients ont bénéficié d'un suivi régulier après leur sortie. La date du dernier suivi était juin 2020, et le statut de survie des patients a été enregistré. La survie globale (OS) a été calculée sur la base de l'intervalle de temps entre le moment de la chirurgie et le moment du décès ou du dernier suivi.
Analyses statistiques
Les variables continues sont présentées sous forme de médiane, de premier et de troisième quartiles, tandis que les variables catégorielles sont exprimées sous forme de nombres et de pourcentages. Selon la valeur seuil de routine dans les applications cliniques, des variables continues telles que l'antigène glucidique 19-9 (CA19-9) et l'antigène carcinoembryonnaire (ACE) ont été converties en variables catégorielles. La valeur seuil optimale pour les biomarqueurs basés sur l'inflammation pour la SG a été calculée à l'aide du logiciel x-tile.
18
La méthode de Kaplan-Meier a été utilisée pour tracer les courbes de survie. Les différences entre les sous-groupes ont été comparées à l'aide de tests de Log rank. Les patients ont été divisés en groupes à SIRI élevé et faible en fonction de la valeur seuil de SIRI optimale. Les corrélations entre les variables clinicopathologiques et les groupes SIRI ont été analysées en utilisant deux échantillons t- ou Mann-Whitney
U
-tests pour les variables continues basés sur la normalité et le chi carré de Pearson ou tests exacts de Fisher pour les variables catégorielles. Toutes les analyses statistiques ont été effectuées à l'aide du logiciel R (version 4.0.2, Institute of Statistics and Mathematics, Vienne, Autriche) et du logiciel SPSS (version 25.0, IBM Corp., Armonk, NY, USA). Un recto-verso
P
valeur < 0,05, a été considérée comme statistiquement significative.
Dans la cohorte de formation, la méthode de régression de Cox a été appliquée à l'analyse univariée. Le modèle de régression multivarié des risques proportionnels de Cox a ensuite été appliqué aux variables avec des valeurs de P ne dépassant pas 0,1, en analyse univariée. Les covariables incluses dans le modèle de prédiction ont été sélectionnées sur la base des résultats de l'analyse de régression de Cox. Un nomogramme pronostique a été établi pour fournir un modèle prédictif à utiliser comme outil de calcul pour prédire la SG.
Dans la cohorte de validation, le modèle de prédiction a été vérifié en mesurant la capacité de discrimination et le calibrage. Nous avons utilisé l'indice de concordance de Harrell (indice C) pour mesurer la capacité de discrimination. La validation était basée sur 1000 rééchantillonnages bootstrap. Le calibrage du modèle a été évalué à l'aide de graphiques de calibrage, et l'effet du calibrage a été évalué avec le test de Hosmer-Lemeshow. Le C-index a également été utilisé pour comparer les capacités de discrimination du modèle de prédiction et du système de classification TNM traditionnel. Une analyse de la courbe de décision (ACD) a également été réalisée pour déterminer l'utilité clinique en calculant les bénéfices nets à différents seuils de probabilité.
19
Résultats
Caractéristiques de base des patients
Cette étude a porté sur 328 patients atteints de cholangiocarcinome. Chez 224 (68,3 %) patients, la tumeur était localisée dans le site extrahépatique et les autres avaient un cholangiocarcinome intrahépatique. Les caractéristiques clinicopathologiques de base des patients de l'étude pour l'ensemble (n=328), la formation (n=232) et les cohortes de validation (n=96) sont présentées dans
Tableau 1
. Dans l'ensemble de la cohorte, 196 (59,8 %) patients étaient des hommes et 132 (40,2 %) étaient des femmes. Cent dix-sept (35,7 %) patients étaient âgés de 65 ans ou plus lorsqu'ils ont subi une intervention chirurgicale. Quarante-six (14,0 %), 78 (54,3 %) et 231 (70,4 %) patients ont développé de la fièvre, une perte de poids et une jaunisse, respectivement, comme diagnostiqué avec un cholangiocarcinome. Des taux sériques élevés de CA19-9 et de CEA ont été observés chez 254 (77,4 %) et 60 (18,3 %) patients, respectivement. Selon la 7e édition de l'AJCC, un (0,3 %), 129 (39,3 %), 119 (36,3 %), 54 (16,5 %) et 25 (7,6 %) patients avaient les stades 0, I, II, III et IV maladie, respectivement. Une résection chirurgicale à visée curative a été réalisée chez 183 (55,8 %) patients ; les autres patients n'ont pas subi de chirurgie radicale. Pour 25 (7,6%) patients atteints d'une maladie TNM de stade IV, une chirurgie palliative a été réalisée pour soulager les symptômes du patient. La durée médiane de suivi était de 18,5 mois (intervalle de 1,0 à 192,0 mois). Enfin, 213 patients (64,9%) sont décédés.
Tableau 1
Caractéristiques de base de tous les patients
Caractéristiques clinicopathologiques selon SIRI
Les valeurs seuil optimales de SIRI, MLR, NLR et PLR générées à l'aide du logiciel x-tile étaient respectivement de 0,68, 0,24, 3,15 et 106,20. Dans les cohortes d'entraînement et de validation, les patients ont été divisés en groupes SIRI élevé (> 0,68) et SIRI faible (≤ 0,68) en fonction de la valeur seuil de SIRI optimale.
Tableau 1
résume les caractéristiques de chaque patient. Par rapport aux patients du groupe SIRI faible dans les cohortes de formation et de validation, le groupe SIRI élevé avait plus de patients âgés de ≥ 65 ans et plus de patients avec une MLR plus élevée, une NLR plus élevée et des taux sériques de lactate déshydrogénase (LDH) élevés. Dans la cohorte de formation, le taux de mortalité est passé de 42,9% à 72,7% entre les groupes SIRI faible et élevé (p=0,000), tandis que celui dans la cohorte de validation est passé de 43,5% à 69,6% (p=0,022). Dans la cohorte d'entraînement, davantage de patients du groupe SIRI élevé ont présenté des niveaux élevés de CA19-9 (p=0,002) et de CEA (p=0,034) ; moins de patients ont subi une chirurgie radicale (56,3 % vs 71,4 %, p = 0,044) et une diminution du temps de suivi médian a été observée (16,50 vs 27,00 mois, p = 0,001) par rapport à ceux du groupe SIRI faible ; aucune différence significative n'a été trouvée dans la cohorte de validation.
Les facteurs prédictifs de l'OS
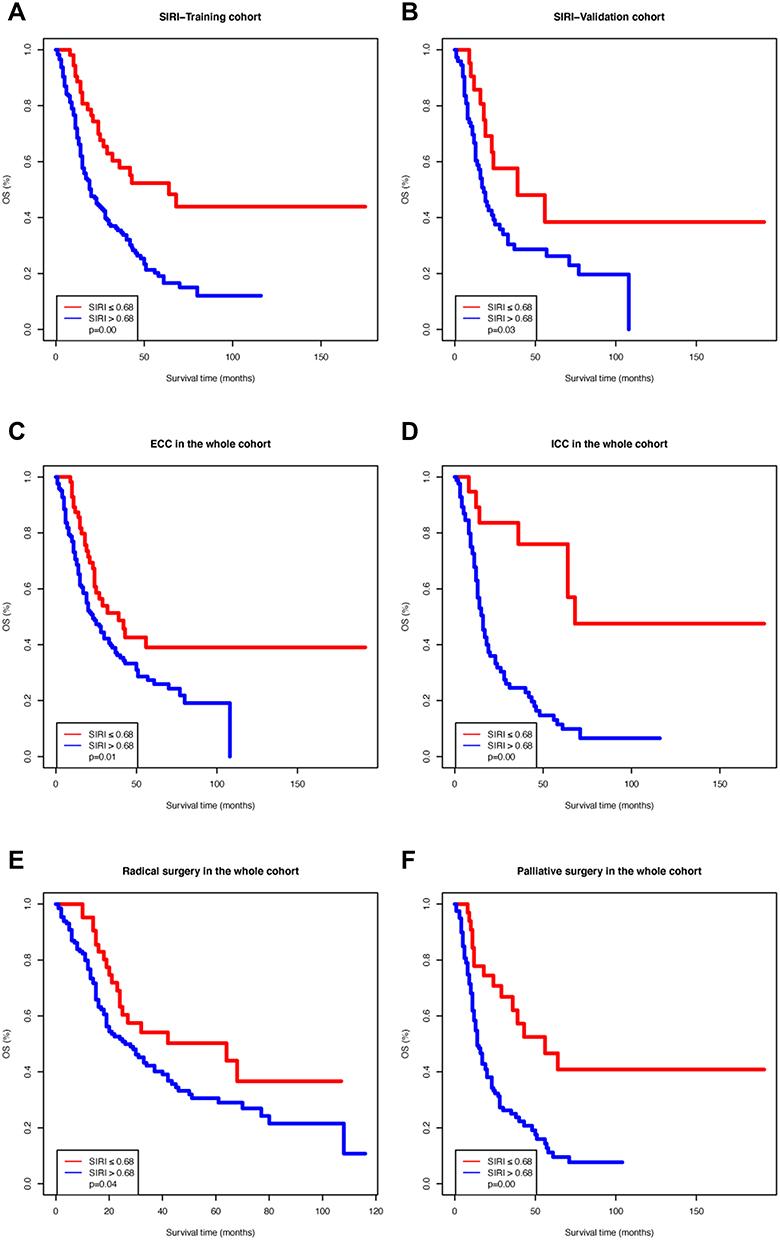
Dans la cohorte d'entraînement, les courbes OS Kaplan-Meier basées sur le SIRI ont montré des différences significatives, ce qui a été confirmé par le test du Log rank (
P
=0.00 ;
Figure 1A
). Le même résultat a été observé dans la cohorte de validation (
P
=0,03 ;
Figure 1B
). De plus, nous avons divisé l'ensemble de la cohorte en fonction de la localisation de la tumeur (cholangiocarcinome extrahépatique [CEC] ou cholangiocarcinome intrahépatique [CCI]) et du type de chirurgie (radicale ou palliative). Les courbes OS Kaplan-Meier selon le SIRI dans les sous-cohortes susmentionnées ont également montré des différences significatives (
Figure 1C
–
F
). Nous avons ensuite effectué une analyse des risques proportionnels de Cox pour la SG dans la cohorte d'entraînement (
Tableau 2
). En analyse univariée, ictère, CA19-9, γ-glutamyl transpeptidase (GGT), phosphatase alcaline (ALP), LDH, albumine (Alb), taille maximale de la tumeur, stade N, stade M, chirurgie radicale et tous les traitements basés sur l'inflammation les biomarqueurs étaient statistiquement associés à la SG (p<0,1). Ensuite, l'analyse multivariée a montré que la jaunisse (hazard ratio [HR] : 2,0980 ; intervalle de confiance à 95 % [IC] : 1,1567–3,805 ;
P
= 0,015), SIRI élevé (HR : 1,8892 ; IC à 95 % : 1,0870-3,2836 ;
P
= 0,002), PLR (RR : 1,9085 ; IC à 95 % : 1,1392–3,1972 ;
P
=0,017), GGT (RR : 2,38 ; IC à 95 % : 1,1313–5,0072 ;
P
= 0,022), taille maximale de la tumeur (HR : 2,5509 ; IC à 95 % : 1,3096–4,969 ;
P
= 0,006), stade N (HR : 1,8034 ; IC à 95 % : 1,2337-2,6364 ;
P
= 0,002), stade M (RR : 4,3937 ; IC à 95 % : 1,1853–16,2874 ;
P
=0,027) et la chirurgie radicale (HR : 0,3675 ; IC à 95 % : 0,2558–0,528 ;
P
= 0,000) étaient des facteurs indépendants pour prédire la SG.
Tableau 2
Analyse des risques proportionnels de Cox univariée et multivariée pour la SG dans la cohorte d'entraînement
Figure 1
Courbes de survie de Kaplan-Meier de différents groupes d'indices de réponse systémique à l'inflammation (SIRI). (
UNE
) Cohorte de formation; (
B
) Cohorte de validation ; (
C
) Patients atteints de cholangiocarcinome extrahépatique ; (
ré
) Patients atteints de cholangiocarcinome intrahépatique ; (
E
) Patients ayant subi une chirurgie radicale ; (
F
) Patients ayant subi une chirurgie palliative.
L'établissement d'un modèle de prédiction pour OS
Le modèle pronostique de la SG a été établi à l'aide de variables obtenues à partir de l'analyse multivariée. Les facteurs clinicopathologiques pronostiques comprenaient huit facteurs de risque, dont SIRI, PLR, ictère, GGT, taille maximale de la tumeur, stade N, stade M et chirurgie radicale. Les courbes des caractéristiques de fonctionnement du récepteur (ROC) en fonction du temps du modèle pronostique comprenant les huit facteurs de risque, le modèle pronostique excluant SIRI et PLR et le système de stadification TNM sont présentés dans
Figure 2A
, qui montre que le modèle intégrant les huit facteurs était beaucoup plus fiable pour prédire la SG que le système de stadification TNM, avec des zones à 1, 3 et 5 ans sous les courbes ROC (AUC) de 0,799, 0,802 et 0,867, respectivement (ASC du système de classification TNM à 1, 3 et 5 ans : 0,607, 0,593 et 0,602, respectivement). Le modèle intégrant tous les facteurs avait également des AUC plus importantes dans la plage à temps plein que celles du modèle sans SIRI et PLR. De plus, les AUC de SIRI étaient également plus élevées que celles des autres biomarqueurs basés sur l'inflammation, y compris MLR, NLR et PLR (
Figure 2B
). Nous avons ensuite construit un nomogramme contenant tous ces huit facteurs pour rendre le modèle pronostique plus visualisé et pratique, comme indiqué dans
figure 3
. Nous avons évalué la capacité prédictive du modèle dans la cohorte d'entraînement à l'aide de l'indice C, qui était de 0,737 (95 % Cl : 0,683-0,791), indiquant une bonne précision de discrimination du nomogramme. L'indice C du système de classification TNM dans la cohorte d'entraînement était de 0,576 (95 % Cl : 0,515-0,637). De plus, les performances du nomogramme ont été évaluées à l'aide de graphiques d'étalonnage à 1, 3 et 5 ans (
Figure 4A
,
C
et
E
). Les lignes prédites et de référence avaient un degré élevé de coïncidence, indiquant une bonne performance du modèle (test de Hosmer-Lemeshow,
P
= 0,458, 0,813 et 0,205 pour la SG à 1, 3 et 5 ans dans la cohorte de formation, respectivement).
Figure 2
Analyse des caractéristiques de fonctionnement du récepteur en fonction du temps (ROC) du modèle pronostique et du système de stadification TNM (
UNE
) et des biomarqueurs basés sur l'inflammation (
B
).
figure 3
Nomogramme pronostique pour prédire la probabilité de survie globale à 1, 3 et 5 ans sur la base du groupe indice de réponse systémique à l'inflammation (SIRI), du groupe rapport plaquettes/lymphocytes (PLR), taille maximale de la tumeur, stade N, stade M , chirurgie radicale, ictère et taux de -glutamyl transpeptidase (GGT) chez les patients atteints de cholangiocarcinome.
Figure 4
Graphique d'étalonnage du nomogramme pour prédire les probabilités de survie globale à 1 (
UNE
et
B
), 3 (
C
et
ré
) et 5 (
E
et
F
) années dans les cohortes de formation et de validation.
Validation de la précision prédictive du nomogramme
Dans la cohorte de validation, l'ASC du nomogramme pour 1, 3 et 5 ans était de 0,822, 0,7
84 et 0,842, respectivement (l'ASC correspondante du système de classification TNM était de 0,566, 0,582 et 0,590, respectivement). De plus, l'indice C du nomogramme pour la prédiction de la SG (0,738, 95%Cl : 0,679-0,797) était significativement plus élevé que celui du système de stadification TNM (0,523, 95%Cl : 0,465-0,581,P
<0,05). Les courbes d'étalonnage à 1, 3 et 5 ans (
Figure 4B
,
ré
et
F
) pour la probabilité de SG a également montré un accord optimal entre l'observation réelle et la prédiction en utilisant le modèle pronostique (test de Hosmer-Lemeshow,
P
= 0,322, 0,174 et 0,792 pour la SG à 1, 3 et 5 ans dans la cohorte de validation, respectivement). De plus, le DCA pour le modèle pronostique et le système de stadification TNM (
Figure 5
) a montré que notre modèle pronostique était plus bénéfique que tous ou aucun des schémas de décès des patients si la probabilité seuil d'un patient était supérieure à 30 %. De plus, dans cette gamme, notre modèle offrait plus d'avantages que le système d'étagement TNM. De plus, par rapport au modèle sans SIRI et PLR, le modèle pronostique intégrant tous les facteurs avait également une utilité clinique préférable, à l'exception du DCA à 5 ans dans la cohorte de validation.
Figure 5
Analyse de la courbe de décision du modèle et du système de mise en scène TNM pour 1- (
UNE
et
B
), 3- (
C
et
ré
) et 5- (
E
et
F
) la survie en années dans les cohortes de formation et de validation.
Comparaison de la précision prédictive pour l'OS entre le nomogramme et le système de stadification TNM
Sur la base du modèle pronostique développé dans cette étude, nous avons divisé l'ensemble de la cohorte en quatre groupes avec des risques différents. Les courbes OS Kaplan-Meier selon le risque du modèle pronostique ont montré des différences significatives, ce qui a été confirmé par le test du Log rank (
P
=0.00,
Figure 6A
). De plus, la classification pronostique du modèle était encore meilleure que celle du système de stadification TNM (
Figure 6B
), avec des courbes plus séparées et aucune ligne de croisement dans la plage à temps plein. De plus, chez les patients atteints d'ECC ou d'ICC, notre modèle a également montré une meilleure performance de prédiction pronostique que celle du système de stadification TNM (
Figure 6C
–
F
).
Figure 6
Courbes de survie de Kaplan-Meier du système de classification Nomogram et TNM dans l'ensemble (
UNE
et
B
), ECC (
C
et
ré
) et ICC (
E
et
F
) cohortes.
Discussion
L'incidence des cholangiocarcinomes a augmenté ces dernières années.
20
,
21
Bien que la chirurgie radicale reste la seule option curative, de nombreux patients sont diagnostiqués à un stade avancé, perdant ainsi l'opportunité d'une guérison. De multiples facteurs contribuent au mauvais pronostic actuel, avec des taux de survie à 5 ans très faibles et des taux de mortalité cumulés augmentant de 39 %.
22
,
23
Ainsi, un outil précis pour prédire le pronostic des patients atteints de cholangiocarcinome est un besoin urgent en milieu clinique pour que les médecins puissent effectuer un traitement individualisé et précis. Bien que le système de stadification TNM pour le cholangiocarcinome soit toujours l'étalon-or, des limitations telles qu'une mauvaise discrimination entre les patients ayant le même stade TNM restent non résolues.
Weinberg et al croyaient que l'inflammation associée aux tumeurs joue un rôle important dans la cancérogenèse et la progression tumorale.
24
L'accumulation de preuves a montré que les biomarqueurs systémiques basés sur l'inflammation, notamment MLR, NLR et PLR, ont un rôle pronostique dans divers types de tumeurs. Plus précisément, dans le cholangiocarcinome, des études antérieures ont montré que le NLR peut prédire la survie des patients atteints d'un cancer des voies biliaires avancé qui reçoivent une chimiothérapie palliative.
dix
En revanche, le PLR est un prédicteur indépendant de la SG chez les patients atteints d'ictère obstructif malin récurrent.
11
Dans la présente étude, SIRI, un biomarqueur basé sur l'inflammation, était un facteur pronostique indépendant chez les patients atteints de cholangiocarcinome. Une valeur SIRI supérieure à 0,68 indiquait un pronostic plus sombre par rapport à une valeur SIRI ≤ 0,68, et était également corrélée à d'autres caractéristiques clinicopathologiques médiocres telles qu'un âge avancé, une LDH sérique élevée et un taux de mortalité accru. Des recherches antérieures axées sur d'autres types de tumeurs solides, telles que le cancer de l'estomac, de l'œsophage et du nasopharynx, ont donné des résultats similaires.
13-15
Cependant, la valeur seuil optimale de SIRI différait selon les études, qui était de 1,2 dans le cancer de l'œsophage et de 1,8 dans le cancer du pancréas.
12
,
14
Dans la présente étude, nous avons utilisé 0,68 comme valeur seuil pour stratifier nos patients et valider son utilité dans la cohorte de validation ; cependant, si ce seuil s'applique à tous les patients atteints de cholangiocarcinome, une validation interinstitutionnelle externe supplémentaire est nécessaire. Pendant ce temps, l'analyse ROC basée sur le temps a montré que SIRI avait une meilleure capacité pronostique dans la plupart des plages de temps par rapport à d'autres biomarqueurs basés sur l'inflammation, notamment MLR, NLR et PLR. L'analyse de régression multivariée de Cox a montré que seuls SIRI et PLR étaient des facteurs pronostiques indépendants parmi tous les biomarqueurs basés sur l'inflammation. Sur la base de ces résultats, nous avons établi un modèle de prédiction innovant intégrant le SIRI, le PLR et d'autres facteurs, qui a démontré une excellente capacité prédictive dans les cohortes de formation et de validation. De plus, par rapport au système de stadification TNM, le modèle établi dans l'étude a montré une bien meilleure précision prédictive avec des AUC beaucoup plus élevées à 1, 3 et 5 ans ainsi qu'un C-index. De plus, par rapport au modèle qui n'intégrait pas le SIRI et le PLR, notre modèle avait des AUC plus élevées pour la plage à temps plein. Notre modèle de prédiction a également montré une meilleure utilité clinique, comme le montre le DCA. De plus, les courbes de Kaplan-Meier de la classification à quatre groupes basée sur notre modèle avaient une meilleure discrimination que le système de classification TNM à la fois dans l'ensemble de la cohorte et dans les cohortes ECC ou ICC. Par conséquent, SIRI a montré un potentiel en tant que marqueur pour prédire le pronostic des patients atteints de cholangiocarcinome. De plus, le modèle basé sur le SIRI et d'autres facteurs avait une valeur prédictive exceptionnelle pour les patients atteints de cholangiocarcinome après résection chirurgicale. Le SIRI et le modèle de prédiction basé sur celui-ci pourraient être appliqués dans le cadre clinique pour développer des schémas thérapeutiques plus précis et personnalisés. À notre connaissance, il s'agit de la première étude à construire un nomogramme intégrant des biomarqueurs basés sur l'inflammation, y compris SIRI et d'autres facteurs clinicopathologiques, pour prédire le pronostic des patients atteints de cholangiocarcinome, qui a montré une meilleure capacité prédictive et une meilleure utilité clinique que celles du modèle qui n'ont pas intégré d'indices basés sur l'inflammation.
Le mécanisme spécifique par lequel un SIRI élevé prédit un mauvais pronostic chez les patients atteints de cholangiocarcinome n'est pas encore clair ; cependant, l'accumulation de preuves a indiqué que les lymphocytes circulants jouent un rôle important dans la défense anti-tumorale en sécrétant plusieurs types de cytokines telles que le facteur de nécrose tumorale alpha (TNF-α) et l'interféron-gamma (IFN-γ) pour induire l'apoptose des cellules cancéreuses .
25
,
26
Ainsi, une diminution du nombre et de la qualité des lymphocytes pourrait entraîner un affaiblissement du système immunitaire et de la défense de la tumeur. De plus, le comptage périphérique des monocytes est associé au niveau de macrophages associés aux tumeurs, ce qui contribue à la progression tumorale et supprime la réponse immunitaire antitumorale.
27
,
28
De même, les neutrophiles circulants peuvent faciliter l'angiogenèse tumorale en produisant un facteur de croissance endothélial vasculaire.
29
De plus, en sécrétant des espèces réactives de l'oxygène et de l'oxyde nitrique, les neutrophiles peuvent empêcher l'activation des lymphocytes T.
30
Par conséquent, les neutrophiles périphériques peuvent être impliqués dans la création d'un microenvironnement tumoral favorable pour favoriser la croissance, l'invasion et les métastases tumorales.
31
Pris ensemble, le SIRI combine les trois nombres de cellules immunitaires périphériques en un seul indice pour traiter les interactions complexes. La diminution des lymphocytes et l'augmentation des monocytes ou des neutrophiles entraîneront un SIRI élevé, ce qui aggravera le pronostic des patients cancéreux. Enfin, en raison de sa commodité, de sa nature non invasive, de son faible prix et de sa reproductibilité, le SIRI peut être appliqué en routine pendant la période de suivi. La valeur préopératoire du SIRI et ses changements dynamiques peuvent servir de biomarqueurs pour l'évaluation de l'efficacité de la chimioradiothérapie adjuvante, de l'immunothérapie ou de la thérapie ciblée, et pour la surveillance d'une éventuelle récidive.
La présente étude présente les limites suivantes. Premièrement, cette recherche n'a étudié que les biomarqueurs basés sur l'inflammation avant la résection chirurgicale ; cependant, les changements dynamiques du SIRI et d'autres facteurs au cours du suivi peuvent également être en corrélation avec les résultats pour les patients, ce qui nécessite une enquête plus approfondie. Deuxièmement, il s'agissait d'une étude rétrospective monocentrique, ce qui peut avoir conduit à un biais potentiel. Bien que les résultats aient été validés dans une cohorte de validation divisée au hasard, une validation externe supplémentaire est nécessaire avant que notre modèle pronostique puisse être largement utilisé. Troisièmement, l'inclusion de différents types de cholangiocarcinome pourrait amplifier l'hétérogénéité des patients. Bien que des analyses de sous-groupes rigoureuses aient été menées pour montrer que la fiabilité des résultats n'était pas manifestement compromise par une telle hétérogénéité, des recherches sont nécessaires pour confirmer davantage les résultats dans l'ICC, le cholangiocarcinome périhilaire et le cholangiocarcinome distal, respectivement. En outre, bien que nous ayons divisé aléatoirement la population globale en une cohorte d'apprentissage et une cohorte de validation, certaines différences dans les caractéristiques de base entre les deux cohortes peuvent entraîner un biais potentiel.
Conclusion
En conclusion, SIRI était un facteur pronostique indépendant chez les patients atteints de cholangiocarcinome. Ce modèle pronostique intégrant SIRI et d'autres facteurs clinicopathologiques a montré une bonne précision prédictive dans la prédiction de la probabilité de survie des patients et était meilleur que le système de stadification TNM. Il peut devenir un outil fiable pour les médecins pour effectuer des évaluations personnalisées pour les patients atteints de cholangiocarcinome.
Abréviations
SIRI, indice de réponse inflammatoire systémique ; ROC, caractéristique de fonctionnement du récepteur ; TMN, métastase ganglionnaire tumorale ; AJCC, American Joint Committee on Cancer; MLR, rapport monocytes/lymphocytes ; NLR, rapport neutrophiles/lymphocytes ; PLR, rapport plaquettes/lymphocytes ; PUMCH, Hôpital du Collège médical de l'Union de Pékin; SG, survie globale ; CA 19-9, antigène glucidique 19-9; CEA, antigène carcinoembryonnaire ; C-index, l'index de concordance de Harrell ; DCA, analyse des courbes de décision ; LDH, lactate déshydrogénase; ECC, cholangiocarcinome extrahépatique ; ICC, cholangiocarcinome intrahépatique ; GGT, glutamyl transpeptidase (GGT); ALP, phosphatase alcaline; Alb, albumine ; HR, rapport de risque ; IC, intervalle de confiance ; AUC, aire sous la courbe caractéristique de fonctionnement du récepteur ; TNF-α, facteur de nécrose tumorale alpha ; IFN-γ, interféron gamma.
Approbation éthique et consentement éclairé
Cette étude a été menée conformément aux normes éthiques de la Déclaration d'Helsinki et a été approuvée par l'Institutional Review Board of Peking Union Medical College Hospital (numéro : S-K1110). Un consentement éclairé écrit a été obtenu de tous les patients.
Remerciements
Les auteurs tiennent à remercier le Dr H. Nikki March et le Dr Vikas Narang d'Editage, pour avoir révisé le texte anglais d'une ébauche de ce manuscrit.
Le financement
Ce travail a été soutenu par des subventions de la National Natural Science Foundation of China (Numéro de subvention : 81972698), du Fonds d'innovation de l'Académie chinoise des sciences médicales (CAMS) pour les sciences médicales (CIFMS) (Numéro de subvention : 2017-I2M-4-002) et Fondation Chen Xiao-Ping pour le développement de la science et de la technologie de la province du Hubei (numéro de subvention : CXPJJH11900001-2019215).
Divulgation
Les auteurs n'ont aucun conflit d'intérêt à déclarer.
Les références
1.
Tyson GL, El-Serag HB. Facteurs de risque de cholangiocarcinome.
Hépatologie
. 2011;54:173-184. doi: 10.1002/hep.24351
2.
Rizvi S, Gores GJ. Pathogenèse, diagnostic et prise en charge du cholangiocarcinome.
Gastro-entérologie
. 2013;145:1215-1229.
3.
Khan SA, Emadossadaty S, Ladep NG et al. Tendances à la hausse du cholangiocarcinome : le système de classification de la CIM nous induit-il en erreur ?
J Hépatol
. 2012;56:848-854. doi:10.1016/j.jhep.2011.11.015
4.
Raoof M, Singh G. Tendances à la hausse de l'incidence et de la mortalité du cholangiocarcinome intrahépatique : s'attaquer à la cause première.
Nutr de chirurgie hépatobiliaire
. 2019;8:301-303. doi:10.21037/hbsn.2019.01.15
5.
Jarnagin WR, Fong Y, DeMatteo RP et al. Stadification, résécabilité et résultat chez 225 patients atteints de cholangiocarcinome hilaire.
Ann Surg
. 2001;234:507. doi: 10.1097/00000658-200110000-00010
6.
de Jong MC, Marques H, Clary BM, et al. L'impact de la résection de la veine porte sur les résultats du cholangiocarcinome hilaire : une analyse multi-institutionnelle de 305 cas.
Cancer
. 2012;118 :4737–4747. doi: 10.1002/cncr.27492
7.
Rizvi S, Khan SA, Hallemeier CL, Kelley RK, Gores GJ. Cholangiocarcinome - évolution des concepts et stratégies thérapeutiques.
Nat Rev Clin Oncol
. 2018;15:95-111. doi: 10.1038/nrclinonc.2017.157
8.
McLean L, Patel T. Variations raciales et ethniques dans l'épidémiologie du cholangiocarcinome intrahépatique aux États-Unis.
Int du foie
. 2006;26:1047-1053.
9.
Diakos CI, Charles KA, McMillan DC, Clarke SJ. Inflammation liée au cancer et efficacité du traitement.
Lancette Oncol
. 2014;15:e493-503. doi:10.1016/S470-2045(14)70263-3
dix.
Ha H, Nam AR, Bang JH, et al. Soluble programmed death-ligand 1 (sPDL1) and neutrophil-to-lymphocyte ratio (NLR) predicts survival in advanced biliary tract cancer patients treated with palliative chemotherapy.
Oncotarget
. 2016;7:76604–76612. doi:10.18632/oncotarget.2810
11.
Jin H, Pang Q, Liu H, et al. Prognostic value of inflammation-based markers in patients with recurrent malignant obstructive jaundice treated by reimplantation of biliary metal stents: a retrospective observational study.
Medicine
. 2017;96:e5895. doi:10.1097/MD.0000000000005895
12.
Qi Q, Zhuang L, Shen Y, et al. A novel systemic inflammation response index (SIRI) for predicting the survival of patients with pancreatic cancer after chemotherapy.
Cancer
. 2016;122:2158–2167. doi:10.1002/cncr.30057
13.
Li S, Lan X, Gao H, et al. Systemic Inflammation Response Index (SIRI), cancer stem cells and survival of localised gastric adenocarcinoma after curative resection.
J Cancer Res Clin Oncol
. 2017;143:2455–2468. doi:10.1007/s00432-017-2506-3
14.
Geng Y, Zhu D, Wu C, et al. A novel systemic inflammation response index (SIRI) for predicting postoperative survival of patients with esophageal squamous cell carcinoma.
Int Immunopharmacol
. 2018;65:503–510. doi:10.1016/j.intimp.2018.10.002
15.
Chen Y, Jiang W, Xi D, et al. Development and validation of nomogram based on SIRI for predicting the clinical outcome in patients with nasopharyngeal carcinomas.
J Investig Med
. 2019;67:691–698. doi:10.1136/jim-2018-000801
16.
World Medical Association. Declaration of Helsinki: ethical principles for medical research involving human subjects.
J Am Coll Dent
. 2014;81:14–18.
17.
Edge SB, Compton CC. The American Joint Committee on Cancer: the 7th edition of the AJCC cancer staging manual and the future of TNM.
Ann Surg Oncol
. 2010;17:1471–1474.
18.
Camp RL, Dolled-Filhart M, Rimm DL. X-tile: a new bio-informatics tool for biomarker assessment and outcome-based cut-point optimization.
Clin Cancer Res
. 2004;10:7252–7259. doi:10.1158/078-0432.CCR-04-713
19.
Vickers AJ, Elkin EB. Decision curve analysis: a novel method for evaluating prediction models.
Med Decis Making
. 2006;26:565–574. doi:10.1177/0272989X06295361
20.
Saha SK, Zhu AX, Fuchs CS, Brooks GA. Forty-Year Trends in Cholangiocarcinoma Incidence in the US: intrahepatic Disease on the Rise.
Oncologist
. 2016;21:594. doi:10.1634/theoncologist.2015-0446
21.
Yang JD, Kim B, Sanderson SO, et al. Biliary tract cancers in Olmsted County, Minnesota, 1976–2008.
Am J Gastroenterol
. 2012;107:1256–1262.
22.
Razumilava N, Gores GJ. Cholangiocarcinoma.
Lancet
. 2014;383:2168–2179. doi:10.1016/S0140-6736(13)61903-0
23.
Antwi SO, Patel T. Increasing mortality of intrahepatic cholangiocarcinoma in the US: are gender-specific risk factors important?
Hepatobiliary Surg Nutr
. 2019;8:635. doi:10.21037/hbsn.2019.10.10
24.
Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation.
Cellule
. 2011;144:646–674. doi:10.1016/j.cell.2011.02.013
25.
Ferrone C, Dranoff G. Dual roles for immunity in gastrointestinal cancers.
J Clin Oncol
. 2010;28:4045–4051. doi:10.1200/JCO.2010.27.9992
26.
Rosenberg SA. Progress in human tumour immunology and immunotherapy.
Nature
. 2001;411:380–384. doi:10.1038/35077246
27.
Franklin RA, Liao W, Sarkar A, et al. The cellular and molecular origin of tumor-associated macrophages.
Science
. 2014;344:921–925. doi:10.1126/science.1252510
28.
Shibutani M, Maeda K, Nagahara H, et al. The peripheral monocyte count is associated with the density of tumor-associated macrophages in the tumor microenvironment of colorectal cancer: a retrospective study.
BMC Cancer
. 2017;17:404. doi:10.1186/s12885-017-3395-1
29.
Kusumanto YH, Dam WA, Hospers GA, Meijer C, Mulder NH. Platelets and granulocytes, in particular the neutrophils, form important compartments for circulating vascular endothelial growth factor.
Angiogenesis
. 2003;6:283–287. doi:10.1023/B:AGEN.0000029415.62384.ba
30.
Müller I, Munder M, Kropf P, Hänsch GM. Polymorphonuclear neutrophils and T lymphocytes: strange bedfellows or brothers in arms?
Trends Immunol
. 2009;30:522. doi:10.1016/j.it.2009.07.007
31.
Liu S, Li N, Yu X, et al. Expression of intercellular adhesion molecule 1 by hepatocellular carcinoma stem cells and circulating tumor cells.
Gastroenterology
. 2013;144:1031–41.e10.
This work is published and licensed by Dove Medical Press Limited. The full terms of this license are available at
https://www.dovepress.com/terms.php
and incorporate the
Creative Commons Attribution - Non Commercial (unported, v3.0) License
.By accessing the work you hereby accept the Terms. Non-commercial uses of the work are permitted without any further permission from Dove Medical Press Limited, provided the work is properly attributed. For permission for commercial use of this work, please see paragraphs 4.2 and 5 of
our Terms
.
Télécharger l'article
[PDF]




