Valentin Chioncel,
1,
*
Catalina Liliana Andrei,
1,
*
Radu Brezeanu,
1,
*
Crina Sinescu,
1,
*
Anamaria Avram,
1,
*
Alin Laurentiu Tatu
2,
*
1
Département de pathologie cardio-thoracique, Faculté de médecine, Université de médecine et de pharmacie « Carol Davila », Bucarest, 050474, Roumanie ;
2
Unité de Recherche Médicale et Pharmaceutique/Plateforme Intégrée de Recherche Compétitive et Interdisciplinaire "Dunărea de Jos", ReForm-UDJG, Centre de Recherche dans le Domaine des Sciences Médicales et Pharmaceutiques, Faculté de Médecine et de Pharmacie, Département de Médecine Clinique, "Dunărea de Jos" Université de Galati, Galati, 800010, Roumanie*Ces auteurs ont contribué à parts égales à ce travailCorrespondance : Valentin ChioncelDépartement de pathologie cardio-thoracique, Faculté de médecine, Université de médecine et de pharmacie "Carol Davila", Bucarest, 050474, RoumanieCourriel
[email protégé]
Résumé:
Le développement des stents coronaires a représenté une révolution dans le traitement des maladies coronariennes. Au-delà de leurs nombreux avantages, les stents ont aussi leurs limites et complications. Les réactions allergiques aux stents coronaires sont plus fréquentes qu'on ne le pense. Ces patients porteurs d'un stent sont exposés à des substances étrangères insérées en contact direct avec l'intima coronaire. L'hypersensibilité aux composants du stent et aux médicaments prescrits après l'insertion du stent ainsi que toute exposition environnementale semblent contribuer à ces effets indésirables. Les patients peuvent se présenter à l'hôpital avec un large éventail de symptômes et de multiples complications, les plus importantes étant la resténose et la thrombose de l'endoprothèse. Bien que peu fréquentes (et pas toujours faciles à identifier), les réactions allergiques après stents coronaires ou périphériques doivent être prises en compte. Une sélection rigoureuse des patients (pour l'implantation élective de stent) en fonction de la propension aux allergies, bien que difficile à réaliser, représente un facteur clé pour réduire le nombre de ces complications.
Mots clés:
endoprothèses, allergie, resténose, thrombose, syndrome de Kounis
introduction
Les maladies cardiovasculaires sont des troubles qui impliquent le cœur ou les vaisseaux sanguins et sont considérées comme la principale cause de morbidité et de mortalité dans le monde.
1
Depuis les premières dilatations par ballonnet en 1977, l'angioplastie coronarienne est devenue le principal traitement des maladies coronariennes.
2
Les principaux inconvénients liés à l'angioplastie par ballonnet – recul élastique du vaisseau et dissections coronaires – ont été atténués par l'implantation d'un stent. La première implantation de stent coronaire chez un être humain en 1984 a représenté un grand pas en avant dans le traitement de ces patients.
Plus de 2 millions de stents sont implantés chaque année dans le monde, la majorité d'entre eux étant pharmacologiquement actifs.
3
Bien qu'il s'agisse d'une étape révolutionnaire dans le traitement des patients coronariens, les stents, comme toute autre thérapie, sont également sujets à des complications ou à des effets secondaires.
Au cours des interventions coronariennes percutanées (ICP), un stent coronaire extensible est placé à l'intérieur de l'artère coupable et la lésion artérielle est une conséquence inévitable de toutes les procédures interventionnelles ; cette blessure déclenche une cascade d'événements cellulaires et moléculaires.
Les stents sont généralement en métal, le nickel, le cobalt et le chrome étant les plus courants. Les réactions allergiques cutanées et extracutanées, ainsi que l'hypersensibilité de type retardée due à une exposition chronique aux métaux sont bien connues et documentées dans la littérature (thrombose du stent, resténose du stent, inflammation, douleur).
Malgré des tentatives et des recherches répétées pour mieux comprendre cette pathologie, l'association entre la sensibilité aux métaux et la réponse allergique aux stents intravasculaires reste à découvrir.
Cette revue peut fournir une mise à jour sur les informations actuelles dans ce domaine et peut être très utile pour les médecins qui rencontrent et gèrent des patients atteints de ces conditions.
Principaux problèmes
Les principales complications de l'implantation du stent sont représentées par la resténose et la thrombose du stent.
4
,
5
La resténose coronaire est la conséquence de l'hyperplasie intimale en réponse à une blessure causée par un ballon/stent. C'était un défi majeur qui a été considérablement réduit après l'apparition des stents imprégnés de substances actives, les soi-disant stents à élution de médicament (DES). Les premières études publiées avec DES (RAVEL, SIRIUS) ont montré un taux de resténose beaucoup plus faible par rapport aux stents en métal nu.
6
,
7
Par la suite, de nombreuses recherches ont confirmé les avantages évidents du DES.
8-10
De nos jours, l'incidence de la resténose de l'instent dans toutes les procédures coronariennes invasives est d'environ 10 à 15 % et le traitement principal est généralement l'insertion d'un autre stent ou l'angioplastie par ballonnet à élution médicamenteuse (DEBA).
11
La thrombose du stent est une complication rare mais parfois critique de l'ICP qui peut entraîner un infarctus du myocarde ou la mort.
12
L'incidence de thrombose de stent varie entre 0,5 % et 2 % et peut survenir malgré les progrès récents de la thérapie et de la technique antiplaquettaires.
13-15
La question a parfois été posée de savoir si ces principales complications (resténose et thrombose du stent) peuvent être liées à des allergies ou à une hypersensibilité aux matériaux du stent. Par conséquent, la recherche actuelle se concentre sur la sécurité des stents coronaires.
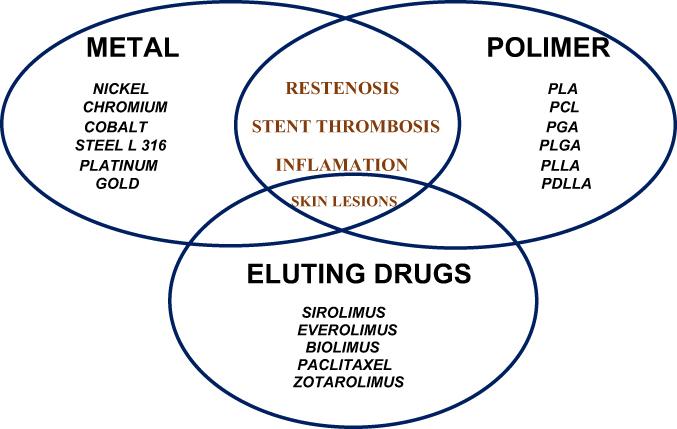
Les réactions d'hypersensibilité au DES représentent un défi croissant et peuvent être le résultat de médicaments élués ou de métaux intrinsèques et de polymères de stent - voir
Figure 1
. Parfois, des médicaments antiplaquettaires peuvent être impliqués, de sorte que la relation de causalité n'est pas très facile à établir.
Figure 1
Effets secondaires d'hypersensibilité des stents.
Au cours des 30 dernières années, il y a eu une préoccupation croissante au sein de la communauté médicale et des patients concernant d'éventuelles réactions allergiques (hypersensibilité) aux matériaux étrangers implantés dans le corps.
L'une des principales questions est de savoir si les réactions d'hypersensibilité aux matériaux provenant des stents artériels intracoronaires pourraient être associées à une resténose et à une thrombose de l'instent.
Resténose instantanée
Les stents en métal nu sont fabriqués à partir d'acier inoxydable, qui est un acier additionné de nickel et de chrome, le nickel étant l'une des causes les plus courantes de dermatite de contact allergique. Les DES contiennent, en plus du cadre métallique, un revêtement polymère (permanent ou biodégradable) dans lequel le médicament antiprolifératif est imprimé.
Conceptuellement, tout composant du stent peut induire une thrombose ou une resténose à médiation immunitaire chez les patients hypersensibles. Des cas concernant une telle réponse néfaste des médicaments antiprolifératifs et des revêtements polymères des stents à élution médicamenteuse ont été rapportés,
16
mais il reste incertain si les composants métalliques du stent peuvent induire un échec local de l'implant lorsqu'ils sont utilisés chez des patients allergiques aux métaux.
Des rapports de cas d'allergies au nickel ont été publiés depuis 1980, avec des estimations d'une incidence globale de 10 % dans la population générale. Parce que l'on pense que la sensibilisation au piercing est la cause dans la majorité des cas, l'incidence chez les femmes est plus élevée, entre 14% et 20%.
17
La plupart des cas rapportés d'allergie au nickel se manifestent par une dermatite de contact courante, mais les patients porteurs d'implants médicaux contenant du nickel qui développent une allergie au nickel ont généralement une réponse systémique plus prononcée, qui comprend fréquemment une éruption eczémateuse diffuse avec une réponse nulle ou faible aux corticostéroïdes.
Les réactions cutanées hypersensibles sont plus souvent décrites au nickel, mais des signes ou symptômes allergiques peuvent également survenir avec d'autres métaux tels que le cobalt, le chrome, le molybdène et l'or.
18
Depuis 1995, les stents coronaires utilisés dans le monde entier ont été conçus en utilisant des plates-formes en acier inoxydable 316 L, en alliage cobalt-chrome ou en alliage platine-chrome et récemment - en chromate de platine (18-20 %) et en molybdène (2,7-9,7 %).
Après l'implantation d'un stent contenant du nickel, le métal est régulièrement libéré dans la circulation systémique, favorisant l'expression de la molécule d'adhésion intercellulaire-1 (ICAM-1) sur les cellules endothéliales, qui joue un rôle important dans le recrutement des cellules inflammatoires de la circulation sanguine.
19
Dans les cas allergiques, la libération d'ions métalliques après contact cutané induit une réaction d'hypersensibilité de type IV médiée par des lymphocytes T allergènes spécifiques, se manifestant par une éruption prurigineuse rouge avec des zones de vésiculation et déclenchant une réponse immunologique excessive.
20
,
21
Malgré des avancées technologiques massives dans la production d'endoprothèses, la resténose des endoprothèses reste un problème clinique majeur et les facteurs prédisposant à la resténose sont encore largement inconnus.
La resténose apparaît généralement dans les 3 à 6 mois suivant l'intervention, mais peut également survenir plus tard.
22-24
Elle est souvent définie comme une revascularisation de la lésion cible et l'incidence dans les stents traditionnels est généralement rapportée entre 10 % et 30 %.
24
,
25
L'allergie de contact aux ions métalliques élués des stents en acier inoxydable, principalement le nickel, le chromate et le molybdène, a été suggérée comme un facteur contribuant à la resténose de l'instent.
26
À cet égard, certaines études cliniques ont suggéré un risque plus élevé de resténose chez les patients qui se sont révélés positifs au patch-test pour une allergie aux métaux après la mise en place du stent.
27
,
28
Cependant, les résultats des études sont contradictoires et il n'y a toujours pas de conclusion ferme dans ce domaine.
Au début des années 2000, malgré des données limitées, la Food and Drug Administration met en garde contre l'implantation de stents chez les patients ayant des antécédents d'allergie aux métaux et a lancé le projet RADAR (Research on Adverse Drug/Device events And Reports) qui examine les associations potentiellement causales entre les agents thérapeutiques et les effets indésirables. événements.
29
En octobre 2003, un avis de la FDA a décrit 50 cas d'hypersensibilité après l'implantation du stent CYPHER
30
avec des symptômes tels qu'une éruption cutanée, une dyspnée, de l'urticaire, des démangeaisons et de la fièvre, mais un mois plus tard (novembre 2003), un avis de suivi a indiqué que presque toutes les réactions d'hypersensibilité étaient causées par un traitement médicamenteux standard associé à l'implantation d'un stent.
31
Les enquêteurs de RADAR ont évalué tous les cas disponibles quant à la possibilité que les composants du DES puissent être une cause de réactions d'hypersensibilité et il s'agissait de la première étude à évaluer les réactions de type hypersensibilité survenues après le placement du DES.
Dans les 2 semaines suivant l'implantation du stent, 85 % de ces patients ont développé des symptômes, notamment une éruption cutanée (78 %), des démangeaisons (27 %), de l'urticaire (23 %), de la fièvre (13 %) et une anaphylaxie (6 %). Les symptômes ont persisté > 30 jours chez 50 % des patients et ont été classés comme graves dans 95 % des cas, 34 % ont nécessité une intervention d'urgence et 18 % une hospitalisation.
Dans seulement 17 des 262 cas d'hypersensibilité signalés à la FDA, le stent lui-même semble être la cause la plus probable des signes d'hypersensibilité.
Selon les critères spécifiques de l'OMS (qui classent les associations causales comme certaines, probables, possibles ou improbables), un seul événement a certainement été causé par un DES, neuf ont probablement été causés par un DES et sept autres cas d'hypersensibilité probable ou certaine causés par un DES ont été identifiés plus tard.
32
Dans deux cas, les signes allergiques étaient certainement dus au clopidogrel. Chez quatre patients présentant une hypersensibilité focale, l'examen nécroptique a révélé des infiltrats éosinophiles instantanés et une mauvaise cicatrisation intimale jusqu'à 18 mois après l'implantation, probablement causés par le DES.
Une étude RADAR a conclu que les composants métalliques et non métalliques du DES pouvaient induire une hypersensibilité. En ce qui concerne les médicaments imprégnés dans les stents, le sirolimus est une cause improbable d'hypersensibilité car il réduit généralement l'infiltration éosinophile et la libération d'histamine et a été associé à de faibles taux d'hypersensibilité,
33
mais l'incidence des réactions allergiques au paclitaxel lui-même n'est pas connue.
34
La matrice polymère peut fragmenter et exposer la structure métallique,
35
faisant craindre que le nickel, le chrome et le molybdène puissent induire une hypersensibilité, le revêtement polymère pourrait donc provoquer des réactions allergiques tardives et persistantes.
36
En conclusion, les résultats de l'étude suggèrent qu'une hypersensibilité locale et systémique peut se développer en réponse à l'implantation de DES dans les artères coronaires. Mais parce que les essais cliniques avec des milliers de patients n'ont pas signalé d'augmentation de la mortalité avec le DES par rapport aux stents en métal nu,
37
,
38
l'incidence des événements d'hypersensibilité fatals dus au DES est susceptible d'être très faible.
La relation entre la réaction allergique aux métaux et le développement d'une resténose de l'instent chez les patients traités avec des stents en acier inoxydable 316 L a été étudiée auparavant. En général, des études cliniques antérieures ont suggéré une propension accrue à la resténose récurrente chez les patients présentant une hypersensibilité aux métaux.
Köster et al
26
ont montré qu'une réaction d'hypersensibilité retardée au nickel et au molybdène pourrait faire partie du processus inflammatoire et être l'un des facteurs déclenchants de la resténose. Son groupe a effectué des tests épicutanés pour les allergies aux métaux sur 131 patients subissant une angiographie répétée pour suspicion de resténose environ 6 mois après la pose d'un stent en métal nu. Parmi ceux-ci, les 10 patients qui ont eu des réactions positives au patch se sont avérés avoir une resténose instantanée. En revanche, seulement 79 (65%) des 121 patients restants (qui étaient patch-négatifs) avaient une resténose. Ainsi, la différence statistiquement significative (p=0,03) suggère que la réaction allergique au métal implanté était un déclencheur de resténose.
Dans le même schéma, Iijima et al
27
ont constaté qu'un patch test positif était un prédicteur significatif de resténose récurrente chez les patients traités avec des stents en acier inoxydable 316 L (
p
=0,02).
Une autre recherche d'Aliağaoğlu et al
39
ont recruté 256 patients qui avaient reçu une endoprothèse coronaire en cobalt-chrome. La coronarographie et les tests épicutanés ont été réalisés indépendamment dans 61 cas et une resténose instantanée a été retrouvée dans 31 d'entre eux. Selon les résultats des tests épicutanés, 7 des 31 patients (23 %) du groupe resténose avaient une allergie de contact au nickel, tandis qu'aucun des 30 patients (0 %) du groupe sans resténose n'avait d'allergie au nickel et la différence s'est avérée être statistiquement significatif (
p
~ 0,006). Par conséquent, les résultats de l'étude ont montré une corrélation entre l'allergie au nickel et la resténose de l'instent chez les patients traités avec des stents en cobalt-chrome.
Des préoccupations spécifiques ont été soulevées concernant les stents plaqués or qui semblaient induire une hypersensibilité systémique ou focale.
Svedman et al
28
,
40
,
41
ont étudié toute relation possible entre l'allergie de contact au matériau du stent, en particulier le nickel et l'or, et la resténose des artères coronaires. Ils ont constaté que les taux de resténose étaient plus élevés chez les patients allergiques à l'or que chez les patients non allergiques. De tels stents ne sont plus utilisés.
Dans une autre étude, Saito et al ont recherché une corrélation entre la positivité du patch et la resténose chez les patients porteurs d'un stent.
42
Ainsi, la positivité du patch était significativement plus fréquente (p ~ 0,02) dans un groupe avec resténose récurrente (9/23) par rapport au groupe sans récidive (5/42), conduisant les auteurs à suggérer que la réaction tissulaire au composant métallique de 316 Le L, en particulier le nickel, peut jouer un rôle important dans la resténose chronique réfractaire.
Les stents coronaires ne sont pas les seuls à pouvoir déterminer l'hypersensibilité. Il existe également des cas de stents périphériques (en Nitinol, à forte teneur en nickel) décrits dans la littérature, qui ont conduit à des réactions allergiques.
43
Certains cas d'allergie importante à l'endoprothèse ont été signalés, qui ont nécessité le retrait du dispositif médical contenant du nickel (ce qui peut ou non être faisable).
Dans un autre exemple, une femme de 70 ans a développé un prurit généralisé et une éruption cutanée, qui sont apparus peu de temps après l'implantation d'un stent métallique iliaque ; le seul moyen de soulager les symptômes était le retrait du stent.
44
De même, il y a eu des rapports de symptômes systémiques graves survenant après la mise en place de dispositifs métalliques de fermeture de foramen ovale perméables, symptômes qui se sont résolus avec le retrait du dispositif.
45
Dans une autre étude portant sur 47 patients ayant subi une fermeture perméable du foramen ovale à l'aide d'un dispositif Amplatzer (50 % de nickel), 5 patients (sur les 8 identifiés par la suite comme allergiques au nickel par patch-test) ont signalé une augmentation de la fréquence des migraines, des douleurs thoraciques , et palpitations après la mise en place du dispositif, significativement plus fréquentes que celles rapportées par les sujets témoins non allergiques.
46
Cependant, il n'y avait pas d'échec de l'implant ou de différences détectables dans les performances du dispositif dans le groupe allergique par rapport aux sujets témoins.
D'autre part, Norgaz et al n'ont trouvé aucune différence entre l'allergie au nickel chez les patients resténoses et les cas sans resténose.
47
Par conséquent, l'étude n'a pas confirmé la relation entre l'allergie au nickel et le développement d'une resténose chez les patients ayant des stents en acier inoxydable.
Une autre petite étude au Danemark a identifié 17 patients qui avaient été stentés dans un passé récent et qui ont développé une dermatite due à une allergie au nickel ou au chrome.
48
Seuls 2 patients ont dû répéter l'intervention coronarienne, statistiquement similaire aux patients non allergiques.
Dans l'analyse de Slodownik, 99 patients ont été suivis – 70 patients avaient des stents perméables à la deuxième angiographie (groupe stents perméables) et 29 présentaient une resténose de l'instent (groupe resténose).
49
Vingt-huit (28,3 %) patients présentaient une allergie à au moins un métal. Il n'y avait pas de différence significative dans la prévalence de l'allergie aux métaux entre le groupe stent perméable et le groupe resténose (28,6 et 27,6 %, respectivement ;
p
= 0,921). Leurs résultats ne soutiennent pas la théorie selon laquelle l'allergie aux métaux joue un rôle dans la pathogenèse de la resténose instantanée.
Une autre étude rétrospective suggère également que l'implantation d'un stent coronaire chez les patients ayant des antécédents d'allergie aux métaux n'est pas associée à des résultats cardiovasculaires précoces ou tardifs défavorables. Romero-Brufau et al ont comparé 29 patients allergiques aux métaux qui ont subi l'implantation d'un stent coronaire à un groupe non allergique (250 patients) appariés pour des données démographiques et une propension à l'allergie aux métaux.
50
Il n'y avait aucune différence dans le nombre de segments traités, les stents placés et la fréquence d'utilisation des stents à élution médicamenteuse. En ce qui concerne les décès à l'hôpital, l'infarctus du myocarde, la mortalité à 30 jours et l'IM, la mortalité à 4 ans, la revascularisation de la lésion cible (TLR) et le décès/MI/TLR, aucune différence statistique n'a été trouvée.
Compte tenu de tout cela, les résultats cliniques après la mise en place d'un stent chez les patients ayant des antécédents d'allergie aux métaux restent flous et les mécanismes restent incomplètement compris.
Les réactions d'hypersensibilité peuvent être causées non seulement par la matrice métallique du stent, mais également par le revêtement polymère (dans le cas du DES).
La structure du DES comprend une matrice polymère, qui permet l'administration de médicaments antiprolifératifs pour inhiber la croissance des cellules musculaires lisses vasculaires.
Le DES de première génération était basé sur des vecteurs de médicaments polymères biostables, tels que le poly(éthylène-co-acétate de vinyle) (PEVA), le poly(méthacrylate de n-butyle) (PBMA) et le poly(styrène-b-isobutylène-b-styrène ) les polymères séquencés (SIBS). Des réactions d'hypersensibilité ont été rapportées
51
,
52
et la persistance des revêtements polymères après la libération du médicament, provoquant une mauvaise réendothélialisation et favorisant une thrombose tardive du stent.
53
Par conséquent, le DES de deuxième génération a été développé avec des polymères biodégradables capables de se dégrader (dans un délai de 6 à 24 mois) une fois sa fonction remplie. Cela a entraîné une diminution des thromboses tardives et très tardives du stent ainsi que des réactions d'hypersensibilité.
Les représentants typiques des polymères biodégradables (qui se dégradent physiologiquement par hydrolyse) sont les acides polyhydroxycarboxyliques, comme le polyglycolide (PGA), les polylactides (PLA) et la poly-caprolactone (PCL). Le PLA a été intensément testé en tant que matériau de stent temporaire en cardiologie en raison de ses longs antécédents de biocompatibilité in vivo.
54
Certains polymères (considérés comme plus biocompatibles), comme le PLA synthétique, mettent des années à se dégrader et présentent donc un risque de thrombose de stent tardive et très tardive. De plus, le PGA peut générer des fragments conduisant potentiellement à des embolies.
55
Par conséquent, les polymères biorésorbables ne sont pas sans risques et sont un travail en cours.
56
Les DES de deuxième et troisième générations utilisent des polymères biomimétiques (tels que la phosphorylcholine - PC, le poly-fluorure de vinylidène-hexafluoropropylène - PVDF-HFP ou le polymère BioLinx), qui n'interfèrent pas avec la réendothélialisation du stent.
57
Récemment, les polymères biodégradables (tels que le PLA et le polylactide-co-glycolide - PLGA) et le DES sans polymère ont été largement étudiés pour optimiser leur biocompatibilité.
58
Cependant, plusieurs études rapportent que les patients traités avec des stents sans polymère présentent des résultats cliniques similaires à ceux traités avec un polymère durable DES en termes de mortalité, de thrombose de stent et d'efficacité à long terme.
59
L'idée d'un échafaudage entièrement biodégradable peut réduire les exigences d'une double thérapie antiplaquettaire à long terme et faciliter le retour de la vasomotion des vaisseaux.
60
Les échafaudages cliniquement approuvés sont principalement basés sur le PLA (un polyL-lactide - PLLA et un polyD,L-lactide - PDLLA). Actuellement, il existe certains inconvénients concernant les réactions inflammatoires agressives lors de l'érosion du polymère conduisant à une resténose instantanée.
61
Par conséquent, les futures tâches pour le développement de biomatériaux utilisés pour des applications médicales ne sont pas seulement d'adapter les conceptions de stents, mais de trouver et de promouvoir des biomatériaux dotés de propriétés antithrombotiques et anti-inflammatoires.
Thrombose du stent/syndrome de Kounis
La thrombose du stent est une complication dramatique du stenting coronaire, souvent présentée comme un infarctus aigu du myocarde ou même une mort subite. Sur la base du moment d'implantation du stent, la thrombose du stent peut être classée comme précoce (0 à 30 jours après l'implantation du stent) ; en retard (>30 jours) ; très tard (>12 mois). Les thromboses tardives et très tardives du stent sont associées à diverses causes, telles qu'une mauvaise endothélialisation, une inflammation, un retard de cicatrisation, une néoathérosclérose et une réaction d'hypersensibilité locale.
62
Cas de thrombose du stent dus à une allergie au stent
27
,
38
ont été rapportés même 2 à 3 ans après l'implantation du stent car la sensibilisation au nickel peut persister pendant de nombreuses années.
63
La thrombose du stent est le résultat d'adhérences, d'activations et d'agrégations en série des plaquettes. L'agrégation plaquettaire est le résultat de la liaison du récepteur GP IIb/IIIa avec le fibrinogène et de l'interaction avec le VWF. La thrombine convertit le fibrinogène en fibrine, qui sert de matrice stable pour la création de thrombus. Par conséquent, les récepteurs des médiateurs d'hypersensibilité participent également à l'activation plaquettaire et ces médiateurs sont dérivés de l'unité allergique des éosinophiles et des mastocytes.
64
Cela peut expliquer pourquoi les patients peuvent développer une thrombose du stent lors d'un épisode allergique.
D'autre part, l'inflammation endothéliale locale (molécule d'adhésion intercellulaire-1 qui recrute les cellules inflammatoires de la circulation sanguine
65
) et une réponse immunitaire excessive (une réaction d'hypersensibilité de type IV médiée par des lymphocytes T spécifiques de l'allergène
15
) jouent un rôle important dans la survenue d'une thrombose de stent.
L'inflammation chronique et le dysfonctionnement endothélial induisent une néoathérosclérose à long terme à l'intérieur des stents en métal nu et à élution médicamenteuse, et la rupture des plaques néoathéroscléreuses joue un rôle important dans la survenue de thrombose de stent tardive et surtout très tardive.
66
L'inflammation étant l'une des principales causes de thrombose du stent,
67
l'administration systémique d'un traitement anti-inflammatoire ou immunosuppresseur (stéroï
des oraux après une ICP lorsqu'une allergie aux métaux est confirmée), en plus d'un double traitement antiplaquettaire, pourrait être bénéfique pour supprimer l'inflammation vasculaire et réduire les taux de thrombose du stent.68–70
Konishi et al ont rapporté un cas de thrombose récurrente du stent chez un patient présentant une allergie avérée au stent qui peut bénéficier d'une corticothérapie systémique.
71
Outre le traitement antiplaquettaire, de faibles doses de stéroïdes pourraient conférer des avantages cliniques et réduire l'incidence de la thrombose du stent en raison de leurs propriétés anti-inflammatoires.
Dans une étude post-mortem, des infiltrations d'éosinophiles ont été observées au site du stent chez des patients présentant une thrombose du stent associée à des allergies au stent.
51
,
72
Par conséquent, les patients qui développent une thrombose répétitive du stent après l'implantation du stent doivent subir un test épicutané à la recherche d'une allergie aux métaux.
Des études récentes ont rapporté une faible incidence de thrombose de stent après implantation d'échafaudages vasculaires biorésorbables où le risque est nettement diminué après l'élution du médicament anti-prolifératif et la résorption de l'échafaudage. Ces preuves peuvent être très importantes chez les patients présentant une allergie aux stents subissant une ICP qui pourraient bénéficier de ces dispositifs.
73
Une autre situation dans laquelle la maladie coronarienne interfère avec les processus pathogènes allergiques est le syndrome de Kounis.
Le syndrome de Kounis est un syndrome coronarien aigu, secondaire à une réaction allergique. Dans ces cas, la libération de cytokines peut précipiter un spasme coronarien, une rupture de plaque ou une thrombose du stent.
Il existe 3 types décrits - le type III (environ 5% des cas de syndrome de Kounis) comprend les patients atteints de thrombose du stent de l'artère coronaire à la suite d'une réaction allergique, avec une présence histologiquement démontrée de mastocytes et d'éosinophiles du thrombus aspiré.
74
,
75
De nombreux cas de syndrome de Kounis de type III ont été rapportés dans la littérature.
Tzanis et al ont décrit un cas curieux de thrombose précoce du stent (4 jours après l'implantation) suite à une réaction allergique à la consommation alimentaire chez un homme de 70 ans.
76
Dans un autre rapport, Tripolino et al ont décrit le cas d'un homme de 47 ans présentant une thrombose aiguë du stent, à la suite d'une réaction allergique aux produits de contraste.
77
30 min après la fin de l'angioplastie (stenting DAL), le patient a présenté des nausées, des sueurs, des douleurs thoraciques, des démangeaisons généralisées suivies de l'apparition d'un érythème cutané. L'ECG a révélé une élévation significative du segment ST en V2-V5 et une angiographie coronaire immédiate a montré une thrombose complète du stent.
Le traitement comprenait de l'hydrocortisone, de la chlorphéniramine, de l'oxygène, une perfusion de sérum physiologique et l'angioplastie a été répétée avec de bons résultats.
Michas et al ont rapporté un cas d'infarctus du myocarde avec élévation du segment ST dû à une thrombose de stent dans le cadre d'une réaction allergique associée à la consommation de champignons.
78
Le syndrome de Kounis peut être un autre exemple du lien entre l'implantation d'un stent et des réactions allergiques, entraînant parfois des complications graves telles que la resténose et la thrombose du stent - voir
Tableau 1
.
Tableau 1
Études ou rapports de cas sur les effets secondaires des stents
Une attention particulière doit être apportée aux patients atteints de syndromes auto-immuns multiples et d'implantation de stent.
79
Chez les patients diabétiques, l'athérosclérose est plus persistante et agressive que chez les patients non diabétiques et le risque cardiovasculaire est particulièrement élevé ; par conséquent, les cas de cardiopathie ischémique et d'accident vasculaire cérébral sont plus du double chez les diabétiques que dans la population non diabétique.
80
C'est la raison pour laquelle le traitement des patients diabétiques atteints de maladie coronarienne doit être beaucoup plus intensif ; Les stents à élution médicamenteuse (DES) constituent ainsi un grand pas en avant dans le domaine des thérapies interventionnelles chez ces patients.
Cependant, la thrombose de l'endoprothèse et la resténose de l'endoprothèse sont plus fréquentes chez les patients diabétiques. La resténose après stenting, causée par une hyperplasie néointimale, reste une préoccupation majeure, en particulier pour la population diabétique. Dans une méta‐analyse de six études, les taux moyens de resténose chez les patients diabétiques étaient 50 % plus élevés que chez les non-diabétiques.
81
Le diabète est également un facteur de risque majeur de thrombose du stent. Dans une étude, le taux de thrombose du stent était 1,8 fois plus élevé chez les patients diabétiques que chez les patients non diabétiques (3,2 % contre 1,7 %).
82
Ce sont quelques-unes des raisons pour lesquelles le pontage aorto-coronarien est souvent préféré à l'angioplastie chez les patients diabétiques. Cependant, il n'existe aucune preuve solide d'un risque plus élevé d'hypersensibilité aux stents chez les patients diabétiques que chez les patients non diabétiques.
En revanche, les experts ne considèrent pas le risque d'allergies secondaires à l'implantation de stent comme un problème majeur.
Morton Kern a répondu par un triple NON pour ce problème de stents coronaires. NON, je ne fais pas de test d'allergie au nickel. NON, je ne traite pas les patients allergiques au nickel. Et, enfin, NON, je ne choisis pas de stents par peur des allergies.
83
Le Dr Greg Stone de l'Université Columbia, NYC, a également commenté : « La plupart des études n'ont pas trouvé de relation solide entre l'allergie au nickel et la resténose ».
Ainsi, malgré les preuves théoriques et les cas rapportés concernant la relation entre l'implant de stent et les réactions allergiques ultérieures, nous ne pouvons actuellement pas connaître l'ampleur de ce problème.
Malgré le fait qu'il s'agisse d'un traitement salvateur, les stents coronaires peuvent parfois provoquer des événements indésirables graves chez ces patients. La matrice métallique, le revêtement polymère, les médicaments élués, les antiplaquettaires et autres médicaments (que prennent les patients porteurs d'un stent) agissent comme un complexe antigénique puissant capable d'induire une réaction allergique et certaines complications comme la resténose et la thrombose de l'endoprothèse.
84
,
85
De nouveaux essais solides et des lignes directrices fondées sur des preuves pour l'évaluation des risques, les tests de diagnostic et le traitement sont nécessaires. Des réactions similaires peuvent survenir après d'autres types de chirurgie avec ou sans inoculation de matériaux considérés comme non-autonomes.
Conclusion
Bien que la resténose et la thrombose du stent soient considérées comme des complications multifactorielles, des variables procédurales, cliniques et angiographiques ont également été incriminées.
Les spécialistes doivent informer leurs collègues de ces complications potentielles. Les patients doivent être interrogés sur leurs antécédents allergiques et informés des risques accrus avant la pose de stents intracoronaires.
Bien qu'il existe des voix qui minimisent cette connexion, le problème ne doit pas être négligé.
Au moins chez les patients porteurs d'un stent souffrant de resténose récurrente ou de thrombose du stent, l'hypersensibilité aux composants du stent joue probablement un rôle important et devrait être une préoccupation majeure. Il reste à prouver si dans ces cas un traitement anti-inflammatoire ou immunosuppresseur (en plus d'une double médication antiplaquettaire) peut être utile pour limiter ces effets secondaires.
Déclaration de partage de données
Toutes les informations sont documentées par des références pertinentes.
Contributions d'auteur
Tous les auteurs ont apporté une contribution significative aux travaux rapportés, que ce soit dans la conception, la conception de l'étude, l'exécution, l'acquisition de données, l'analyse et l'interprétation, ou dans tous ces domaines ; participé à la rédaction, à la révision ou à l'examen critique de l'article ; a donné son approbation finale de la version à publier ; s'être mis d'accord sur la revue à laquelle l'article a été soumis ; et a accepté d'être responsable de tous les aspects du travail.
Le financement
Aucun financement n'a été reçu.
Divulgation
Les auteurs déclarent n'avoir aucun intérêt concurrent.
Les références
1.
Krenning van Luyn GMJ, Harmsen MC. Néovascularisation à base de cellules progénitrices endothéliales : implications pour la thérapie.
Tendances Mol Med
. 2009;15(4):180-189.
2.
Liu T, Liu S, Zhang K, Chen J, Huang N. Endothélialisation des surfaces de biomatériaux cardiovasculaires implantés : le développement d'in vitro à in vivo.
J Biomed Mater Res A
. 2014;102(10):3754–3772.
3.
Lee JH, Kim ED, Jun EJ, Yoo HS, Lee JW. Analyse des tendances et perspectives concernant les stents pour vaisseaux sanguins humains.
Recherche sur les biomatériaux
. 2018;22:8.
4.
Wenaweser P, Rey C, Eberli FR, et al. Thrombose d'endoprothèse après implantation d'une endoprothèse en métal nu : succès d'une intervention coronarienne percutanée d'urgence et facteurs prédictifs d'issue défavorable.
Eur Coeur J
. 2005;26(12):1180-1187.
5.
Windecker S, Meier B. Thrombose tardive du stent coronaire.
Circulation
. 2007;116(17):1952-1965.
6.
Morice MC, Serruys PW, Fajadet J, et al. Groupe d'étude RAVEL - étude randomisée avec l'endoprothèse à ballonnet de vitesse bx revêtue de sirolimus dans le traitement de patients présentant des lésions coronaires natives de novo une comparaison randomisée d'une endoprothèse à élution de sirolimus avec une endoprothèse standard pour la revascularisation coronaire.
N Anglais J Med
. 2002;346(23):1773–1780.
7.
Moses J, Leon M, Popma J, et al. For the SIRIUS Investigators - Sirolimus-eluting stents versus standard stents in patients with stenosis in a native coronary artery.
N Engl J Med
. 2003;349:1315–1323.
8.
Mohan S, Dhall A. A comparative study of restenosis rates in bare metal and drug-eluting stents.
Int J Angiol
. 2010;19(2):e66–e72. doi:10.1055/s-0031-1278368,
9.
Auer J, Leitner A, Berent R, et al. Long-term outcomes following coronary drug-eluting- and bare-metal-stent implantation.
Atherosclerosis
. 2010;210(2):503–509. doi:10.1016/j.2010
dix.
Buccheri D, Piraino D, Andolina G, Cortese B. Understanding and managing in-stent restenosis: a review of clinical data, from pathogenesis to treatment.
J Thorac Dis
. 2016;8(10):E1150–E1162. doi:10.21037/jtd.2016
11.
Mohananey D, Saucedo J, Stone GW, et al. Trends and outcomes of restenosis after coronary stent implantation in the United States.
J Am Coll Cardiol
. 2020;76(13):1521–1531.
12.
Mauri L, Hsieh WH, Massaro JM, Ho KK, D'Agostino R, Cutlip DE. Stent thrombosis in randomized clinical trials of drug-eluting stents.
N Engl J Med
. 2007;356:1020–1029.
13.
Jensen LO, Maeng M, Kaltoft A, et al. Stent thrombosis, myocardial infarction, and death after drug-eluting and bare-metal stent coronary interventions.
J Am Coll Cardiol
. 2007;50:463–470.
14.
Brener SJ, Cristea E, Kirtane AJ, et al. Intra-procedural stent thrombosis: a new risk factor for adverse outcomes in patients undergoing percutaneous coronary intervention for acute coronary syndromes.
JACC Cardiovasc Interv
. 2013;6(1):36–43.
15.
Généreux P, Stone GW, Harrington RA; CHAMPION PHOENIX Investigators, et al.. Impact of intraprocedural stent thrombosis during percutaneous coronary intervention: insights from the CHAMPION PHOENIX trial (Clinical trial comparing cangrelor to clopidogrel standard of care therapy in subjects who require percutaneous coronary intervention).
J Am Coll Cardiol
. 2014;63(7):619.
16.
Chen JP, Hou D, Pendyala L, Goudevenos JA, Kounis NG. Drug-eluting stent thrombosis: the Kounis hypersensitivity-associated acute coronary syndrome revisited.
J Am Coll Cardiol Cardiovasc Interv
. 2009;2:583–593.
17.
Basko-Plluska JL, Thyssen JP, Schalock PC. Cutaneous and systemic hypersensitivity reactions to metallic implants.
Dermatitis
. 2011;22:65–79.
18.
Nielsen NH, Linneberg A, Menne T, et al. Incidence of allergic contact sensitization in Danish adults between 1990 and 1998; the Copenhagen Allergy Study, Denmark.
Br J Dermatol
. 2002;147:487–492.
19.
Wataha JC, O'Dell NL, Singh BB, Whitford GM, Lockwood PE. Relating nickel-induced tissue inflammation to nickel release in vivo.
J Biomed Mater Res
. 2001;58:537–544.
20.
Thomas P, Summer B, Sander CA, Przybilla B, Thomas M, Naumann T. Intolerance of osteosynthesis material: evidence of dichromate contact allergy with concomitant oligoclonal T-cell infiltrate and TH1-type cytokine expression in the peri-implantar tissue.
Allergy
. 2000;55:969–972.
21.
Kornowski R, Hong MK, Tio FO, Bramwell O, Wu H, Leon MB. In-stent restenosis: contributions of inflammatory responses and arterial injury to neointimal hyperplasia.
J Am Coll Cardiol
. 1998;31:224–230.
22.
Beyar R. Novel approaches to reduce restenosis.
Ann NY Acad Sci
. 2004;1015:367–378.
23.
Radke PW, Kaiser A, Frost C, Sigwart H. Outcome after treatment of coronary in-stent restenosis: results from a systematic review using meta-analysis techniques.
Eur Heart J
. 2003;24:266–273.
24.
Cutlip DE, Chauhan MS, Baim DS, et al. Clinical restenosis after coronary stenting: perspectives from multicenter clinical trials.
J Am Coll Cardiol
. 2002;18:2082–2089.
25.
Schiele TM, Krotz F, Klauss V. Vascular restenosis striving for therapy.
Expert Opin Pharmacother
. 2004;5:2221–2232.
26.
Köster R, Vieluf D, Kiehn M, et al. Nickel and molybdenum contact allergies in patients with coronary in-stent restenosis.
Lancette
. 2000;356:1895–1897.
27.
Iijima R, Ikari Y, Amiya E, et al. The impact of metallic allergy on stent implantation: metal allergy and recurrence of in-stent restenosis.
Int J Cardiol
. 2005;104:319–325.
28.
Svedman C, Ekqvist S, Moller H, et al. A correlation found between contact allergy to stent material and restenosis of the coronary arteries.
Contact Dermatitis
. 2009;60:158–164.
29.
Bennett CL, Nebeker JR, Lyons EA, et al. The Research on Adverse Drug Events and Reports (RADAR) project.
JAMA
. 2005;293:2131–2140.
30.
Information for Physicians on Sub-Acute Thromboses (SAT) and Hypersensitivity Reactions with Use of the Cordis CYPHER Coronary Stent.
FDA Public Health Web Notification
.
1st
ed. Rockville, MD: Food and Drug Administration; 2003.
31.
Updated Information for Physicians on Sub-acute Thromboses (SAT) and Hypersensitivity Reactions with Use of the Cordis CYPHER Sirolimus-eluting Coronary Stent.
FDA Public Health Web Notification
.
1st
ed. Rockville, MD: Food and Drug Administration; 2003.
32.
Nebeker JR, Barach P, Samore MH. Clarifying adverse drug events: a clinician's guide to terminology, documentation, and reporting.
Ann Intern Med
. 2004;140:795–801.
33.
Mosby's Drug Consult 2004 - The Comprehensive Reference for Generic and Brand Name Drugs
. St. Louis, MO: Elsevier Inc.; 2004.
34.
Rowinsky EK, Donehower RC. Paclitaxel (Taxol).
N Engl J Med
. 1995;332:1004–1014.
35.
Virmani R, Guagliumi G, Farb A, et al. Localized hypersensitivity and late coronary thrombosis secondary to a sirolimus-eluting stent: should we be cautious?
Circulation
. 2004;109:701–705.
36.
Hillen U, Haude M, Erbel R, Goos M. Evaluation of metal allergies in patients with coronary stents.
Contact Dermatitis
. 2002;47:353–356.
37.
Moses JW, Leon MB, Popma JJ, et al. Sirolimus-eluting stents versus standard stents in patients with stenosis in a native coronary artery.
N Engl J Med
. 2003;349:1315–1323.
38.
Stone GW, Ellis SG, Cox DA, et al. One-year clinical results with the slow-release, polymer-based, paclitaxel-eluting TAXUS stent: the TAXUS-IV trial.
Circulation
. 2004;109:1942–1947.
39.
Aliağaoğlu C, Turan H, Erden I, et al. Relation of nickel allergy with in-stent restenosis in patients treated with cobalt chromium stents.
Ann Dermatol
. 2012;24:4.
40.
Svedman C, Tillman C, Gustavsson CG, Moller H, Frennby B, Bruze M. Contact allergy to gold in patients with gold-plated intracoronary stents.
Contact Dermatitis
. 2005;52:192–196.
41.
Svedman C, Lundh T, Tillman C, Moller H, Gustavsson CG, Bruze M. Gold concentration in blood in patients with gold-plated stents.
Contact Dermatitis
. 2006;54:221–222.
42.
Saito T, Hokimoto S, Oshima S, Noda K, Kojyo Y, Matsunaga K. Metal allergic reaction in chronic refractory in-stent restenosis.
Cardiovasc Revasc Med
. 2009;10:17–22.
43.
Chioncel V, Brezeanu R, Sinescu C. New directions in the management of peripheral artery disease.
Am J Ther
. 2019;26(2):e284–e293.
44.
Guntani A, Kawakubo E, Ryosuke Yoshiga R, et al. Metallic allergy requiring removal of iliac stent: report of a case.
Surg Case Rep
. 2020;6:82.
45.
Khodaverdian RA, Jones KW. Metal allergy to Amplatzer occlude device presented as severe bronchospasm.
Ann Thorac Surg
. 2009;88:2021–2022.
46.
Slavin L, Tobis JM, Rangarajan K, Dao C, Krivokapich J, Liebeskind DS. Five-year experience with percutaneous closure of patent foramen ovale.
Am J Cardiol
. 2007;99:1316–1320.
47.
Norgaz T, Hobikoglu G, Serdar ZA, et al. Is there a link between nickel allergy and coronary stent restenosis?
Tohoku J Exp Med
. 2005;206:243–246.
48.
Thyssen JP, Engkilde K, Menne T, Johansen JD, Hansen PR, Gislason GH. No association between metal allergy and cardiac in-stent restenosis in patients with dermatitis-results from a linkage study.
Contact Dermatitis
. 2011;64:138–141.
49.
Slodownik C, Danenberg C, Merkin D, et al. Coronary stent restenosis and the association with allergy to metal content of 316L stainless steel.
Cardiovasc J Afr
. 2018;29:43–45.
50.
Romero-Brufau S, Best PJM, Holmes DR, et al. Outcomes after coronary stent implantation in patients with metal allergy.
Circ Cardiovasc Interv
. 2012;5:220–226.
51.
Virmani R, Kolodgie FD, Farb A. Drug-eluting stents: are they really safe?
Am Heart Hosp J
. 2004;2(2):85–88.
52.
Nebeker R, Virmani C, Bennett L, et al. Hypersensitivity cases associated with drug-eluting coronary stents: a review of available cases from the Research on Adverse Drug Events and Reports (RADAR) project.
J Am Coll Cardiol
. 2006;47(1):175–181.
53.
Farb A, Burke AP, Kolodgie FD, Virmani R. Pathological mechanisms of fatal late coronary stent thrombosis in humans.
Circulation
. 2003;108(14):1701–1706.
54.
van Alst M, Eenink MJD, Kruft MAB, Van Tuil R. ABC's of bioabsorption: application of lactide based polymers in fully resorbable cardiovascular stents.
EuroIntervention
. 2009;5:F23–F27.
55.
Ceonzo K, Gaynor A, Shaffe L, Kojima K, Vacanti CA, Stahl GL. Polyglycolic acid-induced inflammation: role of hydrolysis and resulting complement activation.
Tissue Eng
. 2006;12(2):301–308.
56.
Serruys PW, Kukreja N. Late stent thrombosis in drug eluting stents: return of the 'VB syndrome'.
Nat Clin Pract Cardiovasc Med
. 2006;3(12):637.
57.
Ong AT, Serruys PW. Technology insight: an overview of research in drug-eluting stents.
Nat Clin Pract Cardiovasc Med
. 2005;2(12):647–658.
58.
Patel MJ, Patel SS, Patel NS, Patel NM. Current status and future prospects of drug eluting stents for restenosis.
Acta Pharmaceutica
. 2012;62(4):473–496.
59.
Navarese EP, Kowalewski M, Cortese B, et al. Short and long term safety and efficacy of polymer-free vs. durable polymer drug-eluting stents.A comprehensive meta-analysis of randomized trials including 6178 patients.
Atherosclerosis
. 2014;233(1):224–231.
60.
Campos CM, Muramatsu T, Iqbal J, et al. Bioresorbable drug-eluting magnesium-alloy scaffold for treatment of coronary artery disease.
Int J Mol Sci
. 2013;14(12):24492–24500.
61.
Smith EJ, Jain AK, Rothman MT. New developments in coronary stent technology.
J Interv Cardiol
. 2006;19(6):493–499.
62.
Joner M, Finn AV, Farb A, et al. Pathology of drug-eluting stents in humans: delayed healing and late thrombotic risk.
J Am Coll Cardiol
. 2006;48:193–202.
63.
Nguyen SH, Dang TP, MacPherson C, Maibach H, Maibach HI. Prevalence of patch test results from 1970 to 2002 in a multi-centre population in North America (NACDG).
Contact Dermatitis
. 2008;58:101–106.
64.
Minai-Fleminger Y, Levi-Schaffer F. Mast cells and eosinophils: the two key effector cells in allergic inflammation.
Inflamm Res
. 2009;58:e631–e638.
65.
Wataha JC, O'Dell NL, Singh BB, Ghazi M, Whitford GM, Lockwood PE. Relating nickel-induced tissue inflammation to nickel release in vivo.
J Biomed Mater Res
. 2001;58:537–544.
66.
Nakazawa G, Otsuka F, Nakano M, et al. The pathology of neoatherosclerosis in human coronary implants bare-metal and drug-eluting stents.
J Am Coll Cardiol
. 2011;57:1314–1322.
67.
Farb A, Sangiorgi G, Carter AJ, et al. Pathology of acute and chronic coronary stenting in humans.
Circulation
. 1999;99:44–52.
68.
Ribichini F, Tomai F, De Luca G, et al. Immunosuppressive therapy with oral prednisone to prevent restenosis after PCI. A multicenter randomized trial.
Am J Med
. 2011;124:434–443.
69.
Rhen T, Cidlowski JA. Antiinflammatory action of glucocorticoids–new mechanisms for old drugs.
N Engl J Med
. 2005;353:1711–1723.
70.
Chioncel V, Avram A, Sinescu C. A particular case of Wellens' syndrome.
Med Hypotheses
. 2020;144:110013.
71.
Konishi T, Yamamoto T, Funayama T, et al. Stent thrombosis caused by metal allergy complicated by protein S deficiency and heparin-induced thrombocytopenia: a case report and review of the literature.
Thromb J
. 2015;13:25.
72.
Tatu AL, Baroiu L, Fotea S, et al. A working hypothesis on vesicular lesions related to COVID-19 infection, Koebner Phenomena Type V, and a short review of related data.
Clin Cosmet Investig Dermatol
. 2021;14:419–423.
73.
Verheye S, Ormiston JA, Stewart J, et al. A next-generation bioresorbable coronary scaffold system: from bench to first clinical evaluation: 6- and 12-month clinical and multimodality imaging results.
JACC Cardiovasc Interv
. 2014;7:89–99.
74.
Sciatti E, Vizzardi E, Cani DS, et al. Kounis syndrome, a disease to know: case report and review of the literature.
Monaldi Arch Chest Dis
. 2018;88:898.
75.
Kounis NG. Coronary hypersensitivity disorder: the Kounis syndrome.
Clin Ther
. 2013;35:563–571.
76.
Tzanis G, Bonou M, Mikos N, et al. Early stent thrombosis secondary to food allergic reaction: kounis syndrome following rice pudding ingestion.
World J Cardiol
. 2017;9:283–288.
77.
Tripolino C, Tassone EJ, Morabito G, Grillo P, Missiroli B. Acute coronary stent thrombosis: a case of type 3 Kounis syndrome.
J Cardiol Cases
. 2019;19:33–35.
78.
Michas G, Stougiannos P, Thomopoulos T, et al. Acute anterior myocardial infarction due to stent thrombosis after mushroom consumption: a case of Kounis type III syndrome.
Hellenic J Cardiol
. 2017;58:378–380.
79.
Tatu AL, Ionescu MA. Multiple autoimmune syndrome type III - thyroiditis, vitiligo and alopecia areata.
Acta Endo (Buc)
. 2017;13(1):124–125.
80.
Seabra‐Gomes R. Percutaneous coronary interventions with drug eluting stents for diabetic patients.
Cœur
. 2006;92(3):410–419.
81.
Gilbert J, Raboud J, Zinman B. Meta‐analysis of the effect of diabetes on restenosis rates among patients receiving coronary angioplasty stenting.
Diabetes Care
. 2004;27:990–994.
82.
Machecourt J, Danchin N, Lablanche JM, et al. Risk factors for stent thrombosis after implantation of sirolimus-eluting stents in diabetic and nondiabetic patients: the EVASTENT matched-cohort registry.
J Am Coll Cardiol
. 2007;50(6–7):501–508.
83.
Kern M. How should we manage nickel allergy in patients needing coronary stents?
Cathlabdigest
. 2011;19:1.
84.
Tatu AL, Elisei AM, Chioncel V, Miulescu M, Nwabudike LC. Immunologic adverse reactions of β-blockers and the skin.
Exp Ther Med
. 2019;18(2):955–959.
85.
Kounis NG, Mazarakis A, Tsigkas G. Giannopoulos S and Goudevenos J. Kounis syndrome: a new twist on an old disease.
Future Cardiol
. 2011;7:e805–e824.




