Autores
Jin B, Hu W, Su S, Xu H, Lu X,
Cantó X
,
Yang H
,
Mao Y
,
Du S
Recibió
28 de abril de 2021
Aceptado para publicación
26 de julio de 2021
Publicado
10 de agosto de 2021 Volumen 2021: 13 páginas 6263—6277
DOI
https://doi.org/10.2147/CMAR.S317954
Comprobado por plagio
sí
Revisado por
Revisión individual anónima por pares
Comentarios del revisor de pares
3
Editor que aprobó la publicación:
Dr. Beicheng Sun
Descargar Articulo
[PDF]
Bao Jin,
1,
& ast;
Wenmo Hu,
2,
& ast;
Si Su,
2,
& ast;
Haifeng Xu,
1
Xin Lu,
1
Xinting Sang,
1
Huayu Yang,
1
Yilei Mao,
1
Shunda Du
1
1
Departamento de Cirugía Hepática, Peking Union Medical College Hospital (PUMCH), Peking Union Medical College (PUMC) y Academia China de Ciencias Médicas (CAMS), Beijing, 100730, República Popular de China;
2
Peking Union Medical College (PUMC) y Academia China de Ciencias Médicas (CAMS), Beijing, 100730, República Popular de China & ast; Estos autores contribuyeron igualmente a este trabajoCorrespondencia: Shunda Du; Yilei Mao Departamento de Cirugía Hepática, Hospital de la Facultad de Medicina de la Unión de Pekín (PUMC), PUMC y Academia China de Ciencias Médicas, Beijing, 100730, República Popular de China
[correo electrónico protegido]
;
[correo electrónico protegido]
Objetivo:
Determinamos el valor pronóstico del índice de respuesta inflamatoria sistémica (SIRI) en pacientes con colangiocarcinoma después de la cirugía y construimos un modelo de predicción de supervivencia basado en SIRI.
Pacientes y métodos:
Reclutamos a 328 pacientes con colangiocarcinoma confirmado histopatológicamente de 2003 a 2017 y realizamos análisis de Cox y de supervivencia de Kaplan-Meier para analizar el valor pronóstico del SIRI e identificar otros factores significativos. Se estableció un nomograma que involucraba SIRI y otros factores clínico-patológicos basado en la cohorte de entrenamiento. El índice de concordancia (índice C), el análisis de la curva de decisión, los gráficos de calibración y la prueba de Hosmer-Lemeshow se utilizaron para evaluar la utilidad clínica del nomograma y compararlo con el sistema de estadificación TNM tradicional. Los resultados se validaron mediante una cohorte de validación separada.
Resultados:
Los pacientes se dividieron aleatoriamente en cohortes de entrenamiento (n = 232) y de validación (n = 96). En la cohorte de entrenamiento, los factores independientes derivados del análisis multivariado de Cox fueron SIRI, relación plaquetas / linfocitos, ictericia, nivel de γ-glutamil transpeptidasa, tamaño máximo del tumor, estadio N, estadio M y cirugía radical. Las curvas de características operativas del receptor dependientes del tiempo (ROC) mostraron un AUC más alto para SIRI que para otros biomarcadores basados en inflamación. Un nomograma que contiene todos los factores independientes mostró una buena discriminación y calibración. Los valores del índice C para la supervivencia general, 0,737 (IC del 95%: 0,683 a 0,791) y 0,738 (IC del 95%: 0,679 a 0,797) en las cohortes de entrenamiento y validación, respectivamente, fueron significativamente mejores que los del sistema de estadificación TNM [ 0,576 (95% Cl: 0,515– 0,637) y 0,523 (95% Cl: 0,465– 0,581), respectivamente].
Conclusión:
El SIRI fue un factor pronóstico independiente para el colangiocarcinoma. Un modelo de pronóstico basado en SIRI podría ayudar a los médicos a estratificar a los pacientes con mayor precisión y proporcionar un tratamiento individualizado.
Palabras clave:
índice de respuesta inflamatoria sistémica, colangiocarcinoma, pronóstico, nomograma, supervivencia
Introducción
Colangiocarcinoma, el segundo tumor maligno hepatobiliar más común después del carcinoma hepatocelular,
1
se origina en el epitelio de las vías biliares y puede afectar a cualquier parte del árbol biliar.
2
Según los informes, la incidencia de colangiocarcinoma ha aumentado en los últimos años,
3
,
4
con tasas ajustadas por edad entre 2.1 por 100,000 en poblaciones negras y no hispanas y 2.8-3.3 por 100,000 en personas asiáticas e hispanas.
1
Dado que la mayoría de los pacientes en la etapa inicial son asintomáticos, una gran proporción tiene enfermedad en etapa avanzada en el momento de la presentación. Por lo tanto, solo aproximadamente el 35% de los pacientes en una etapa temprana tienen la posibilidad de someterse a una resección quirúrgica con intención curativa.
5
Además, casi el 30% de los pacientes que se consideran resecables en las pruebas de imagen iniciales son irresecables durante la exploración, lo que da como resultado márgenes positivos en los informes patológicos finales.
6
Todos estos factores contribuyen al mal pronóstico de los pacientes con colangiocarcinoma, y la mortalidad es paralela a su tasa de incidencia (aproximadamente 1,0 por 100.000).
7
,
8
Por lo tanto, se necesita con urgencia una predicción precisa del resultado de los pacientes con colangiocarcinoma. El sistema de estadificación TNM es actualmente el estándar más utilizado para la estadificación del cáncer. Sin embargo, otros factores clínico-patológicos también pueden jugar un papel crucial en el resultado de los pacientes con colangiocarcinoma, lo que lleva a una considerable heterogeneidad en el pronóstico clínico entre los pacientes con el mismo estadio. Por lo tanto, se necesitan con urgencia modelos de pronóstico más precisos para el colangiocarcinoma en el entorno clínico.
Se reconoce ampliamente que la respuesta inflamatoria es un factor importante en el desarrollo y la progresión del cáncer.
9
La información sobre algunas células inmunoinflamatorias, como los neutrófilos, los monocitos, las plaquetas y los linfocitos, se puede obtener fácilmente mediante la realización de una prueba de hemograma completo. En base a esto, se han investigado los biomarcadores basados en la inflamación que incluyen la proporción de neutrófilos a linfocitos (NLR), la proporción de monocitos a linfocitos (MLR) y la proporción de plaquetas a linfocitos (PLR), y su valor pronóstico en el colangiocarcinoma ha sido investigado. sido ilustrado.
10
,
11
Recientemente, Qi et al propusieron un biomarcador innovador basado en la inflamación que integra recuentos periféricos de neutrófilos, monocitos y linfocitos, a saber, el índice de respuesta a la inflamación sistémica (SIRI).
12
Estudios posteriores han informado de la capacidad pronóstica de SIRI en tumores sólidos, como cánceres de esófago, gástrico, páncreas y nasofaringe.
13-15
Sin embargo, todavía hay una falta de evidencia que muestre si SIRI puede ser un indicador pronóstico para predecir el resultado de los pacientes con colangiocarcinoma. Además, hasta donde sabemos, todavía no existe un modelo de pronóstico que incluya biomarcadores basados en la inflamación para el colangiocarcinoma.
Por lo tanto, nuestra investigación tuvo como objetivo estudiar el valor pronóstico de SIRI utilizando una cohorte de pacientes con colangiocarcinoma después de la resección quirúrgica, y construir un modelo pronóstico que integre el SIRI en una cohorte de entrenamiento y probar su precisión predictiva en una cohorte de validación.
Pacientes y métodos
Pacientes
Desde el 1 de enero de 2003 hasta el 31 de diciembre de 2017, los pacientes que recibieron tratamiento quirúrgico en nuestra institución y cuyo informe patológico reveló colangiocarcinoma fueron reclutados retrospectivamente para este estudio.
Los criterios de inclusión del estudio fueron: (1) colangiocarcinoma como diagnóstico primario, que se confirmó mediante un examen histopatológico, (2) cirugía realizada por colangiocarcinoma, (3) los resultados de los análisis de sangre de rutina medidos dentro de los siete días anteriores a la cirugía estaban disponibles y ( 4) los datos de seguimiento postoperatorio y la información clínico-patológica estaban completos y disponibles.
Los criterios de exclusión del estudio fueron: (1) falta de diagnóstico histopatológico definitivo de colangiocarcinoma, (2) falta de información clínico-patológica, (3) datos de seguimiento incompletos y (4) presencia comórbida de otros tumores malignos.
Después del cribado, los 328 pacientes que se inscribieron posteriormente cumplieron con los criterios de inclusión. La cohorte completa se dividió aleatoriamente en cohortes de entrenamiento y validación en una proporción de 7: 3 utilizando el paquete "caret" de la versión R 3.6.2.
Declaración de Ética
Este estudio fue aprobado por la Junta de Revisión Institucional del Hospital del Colegio Médico de la Unión de Pekín (PUMCH) (No: S-K1110). Se obtuvo el consentimiento informado de todos los pacientes de acuerdo con el reglamento del Comité. El estudio se realizó de acuerdo con los estándares éticos de la Declaración de Helsinki.
dieciséis
Recopilación de datos
Los registros médicos relacionados se revisaron manualmente para obtener información demográfica y clínica. Recopilamos la información demográfica de los pacientes, los síntomas clínicos, los resultados de las pruebas de suero, los informes quirúrgicos y los resultados histopatológicos. Los biomarcadores inflamatorios, incluidos SIRI, NLR, MLR y PLR, se definieron de la siguiente manera: SIRI = N * M / L, NLR = N / L, MLR = M / L y PLR = P / L, donde N, M , L y P se refieren a los recuentos periféricos de neutrófilos, monocitos, linfocitos y plaquetas, respectivamente. Se utilizó la séptima edición del sistema de clasificación TNM del AJCC para determinar los estadios TNM clínicos preoperatorios y postoperatorios patológicos.
17
Los márgenes de la incisión y el tamaño máximo del tumor se determinaron en función de los informes histopatológicos finales. La cirugía radical se definió como el requisito de protocolos quirúrgicos radicales con márgenes incisionales microscópicamente negativos. Todos los pacientes fueron sometidos a un seguimiento regular después del alta. El momento del último seguimiento fue junio de 2020 y se registró el estado de supervivencia de los pacientes. La supervivencia global (SG) se calculó sobre la base del intervalo de tiempo desde el momento de la cirugía hasta el momento de la muerte o el último seguimiento.
Análisis estadístico
Las variables continuas se presentan como mediana, primer y tercer cuartiles, mientras que las variables categóricas se expresan como números y porcentajes. De acuerdo con el valor de corte de rutina en aplicaciones clínicas, las variables continuas como el antígeno carbohidrato 19-9 (CA19-9) y el antígeno carcinoembrionario (CEA) se convirtieron en variables categóricas. El valor de corte óptimo para los biomarcadores basados en la inflamación para la SG se calculó mediante el software x-tile.
18
Se utilizó el método de Kaplan-Meier para dibujar las curvas de supervivencia. Las diferencias entre subgrupos se compararon mediante pruebas de rango logarítmico. Los pacientes se dividieron en grupos de SIRI alto y bajo de acuerdo con el valor de corte de SIRI óptimo. Las correlaciones entre las variables clínico-patológicas y los grupos SIRI se analizaron utilizando t de dos muestras o Mann-Whitney
U
-pruebas para variables continuas basadas en normalidad y chi-cuadrado de Pearson o pruebas exactas de Fisher para variables categóricas. Todos los análisis estadísticos se realizaron utilizando el software R (versión 4.0.2, Instituto de Estadística y Matemáticas, Viena, Austria) y el software SPSS (versión 25.0, IBM Corp., Armonk, NY, EE. UU.). A dos caras
PAG
valor de <0,05, se consideró estadísticamente significativo.
En la cohorte de entrenamiento, se aplicó el método de regresión de Cox al análisis univariado. A continuación, se aplicó el modelo multivariante de regresión de riesgos proporcionales de Cox a las variables con valores de p no mayores a 0,1, en análisis univariante. Las covariables incluidas en el modelo de predicción se seleccionaron en función de los resultados del análisis de regresión de Cox. Se estableció un nomograma de pronóstico para proporcionar un modelo predictivo que se utilizará como herramienta de cálculo para predecir la SG.
En la cohorte de validación, el modelo de predicción se verificó midiendo la capacidad de discriminación y la calibración. Usamos el índice de concordancia de Harrell (índice C) para medir la capacidad de discriminación. La validación se basó en 1000 remuestreos bootstrap. La calibración del modelo se evaluó mediante gráficos de calibración y el efecto de la calibración se evaluó con la prueba de Hosmer-Lemeshow. El índice C también se utilizó para comparar las capacidades de discriminación del modelo de predicción y el sistema de estadificación TNM tradicional. También se llevó a cabo un análisis de la curva de decisión (DCA) para determinar la utilidad clínica mediante el cálculo de los beneficios netos a diferentes probabilidades de umbral.
19
Resultados
Características basales de los pacientes
Este estudio investigó a 328 pacientes con colangiocarcinoma. En 224 (68,3%) pacientes, el tumor se localizó en el sitio extrahepático y el resto tuvo colangiocarcinoma intrahepático. Las características clínico-patológicas basales de los pacientes del estudio para las cohortes totales (n = 328), de entrenamiento (n = 232) y de validación (n = 96) se muestran en
tabla 1
. En toda la cohorte, 196 (59,8%) pacientes eran hombres y 132 (40,2%) eran mujeres. Ciento diecisiete (35,7%) pacientes tenían 65 años o más cuando se sometieron a la cirugía. Cuarenta y seis (14,0%), 78 (54,3%) y 231 (70,4%) pacientes desarrollaron fiebre, pérdida de peso e ictericia, respectivamente, como se les diagnosticó colangiocarcinoma. Se observaron niveles elevados de CA19-9 y CEA en suero en 254 (77,4%) y 60 (18,3%) pacientes, respectivamente. Según la 7a edición del AJCC, uno (0,3%), 129 (39,3%), 119 (36,3%), 54 (16,5%) y 25 (7,6%) pacientes tenían estadio 0, I, II, III y IV enfermedad, respectivamente. La resección quirúrgica con intención curativa se logró en 183 (55,8%) pacientes; los pacientes restantes no se sometieron a cirugía radical. Para 25 (7,6%) pacientes con enfermedad en estadio IV TNM, se realizó cirugía paliativa para aliviar los síntomas del paciente. La mediana del tiempo de seguimiento fue de 18,5 meses (rango de 1,0 a 192,0 meses). Finalmente, fallecieron 213 pacientes (64,9%).
tabla 1
Características basales de todos los pacientes
Características clínico-patológicas según SIRI
Los valores de corte óptimos de SIRI, MLR, NLR y PLR generados con el software x-tile fueron 0,68, 0,24, 3,15 y 106,20, respectivamente. En las cohortes de entrenamiento y validación, los pacientes se dividieron en grupos de SIRI alto (> 0,68) y SIRI bajo (≤0,68) según el valor de corte de SIRI óptimo.
tabla 1
resume las características de cada paciente. En comparación con los pacientes del grupo de SIRI bajo en las cohortes de entrenamiento y validación, el grupo de SIRI alto tenía más pacientes de ≥ 65 años y más pacientes con MLR más alto, NLR más alto y niveles elevados de lactato deshidrogenasa (LDH) sérica. En la cohorte de entrenamiento, la tasa de mortalidad aumentó de 42,9% a 72,7% entre los grupos de SIRI bajo y alto (p = 0,000), mientras que en la cohorte de validación aumentó de 43,5% a 69,6% (p = 0,022). En la cohorte de entrenamiento, más pacientes en el grupo de SIRI alto experimentaron niveles elevados de CA19-9 (p = 0,002) y CEA (p = 0,034); menos pacientes se sometieron a cirugía radical (56,3% vs 71,4%, p = 0,044) y se observó una disminución del tiempo medio de seguimiento (16,50 vs 27,00 meses, p = 0,001) en comparación con los del grupo de bajo SIRI; no se encontraron diferencias significativas en la cohorte de validación.
Los factores predictivos del sistema operativo
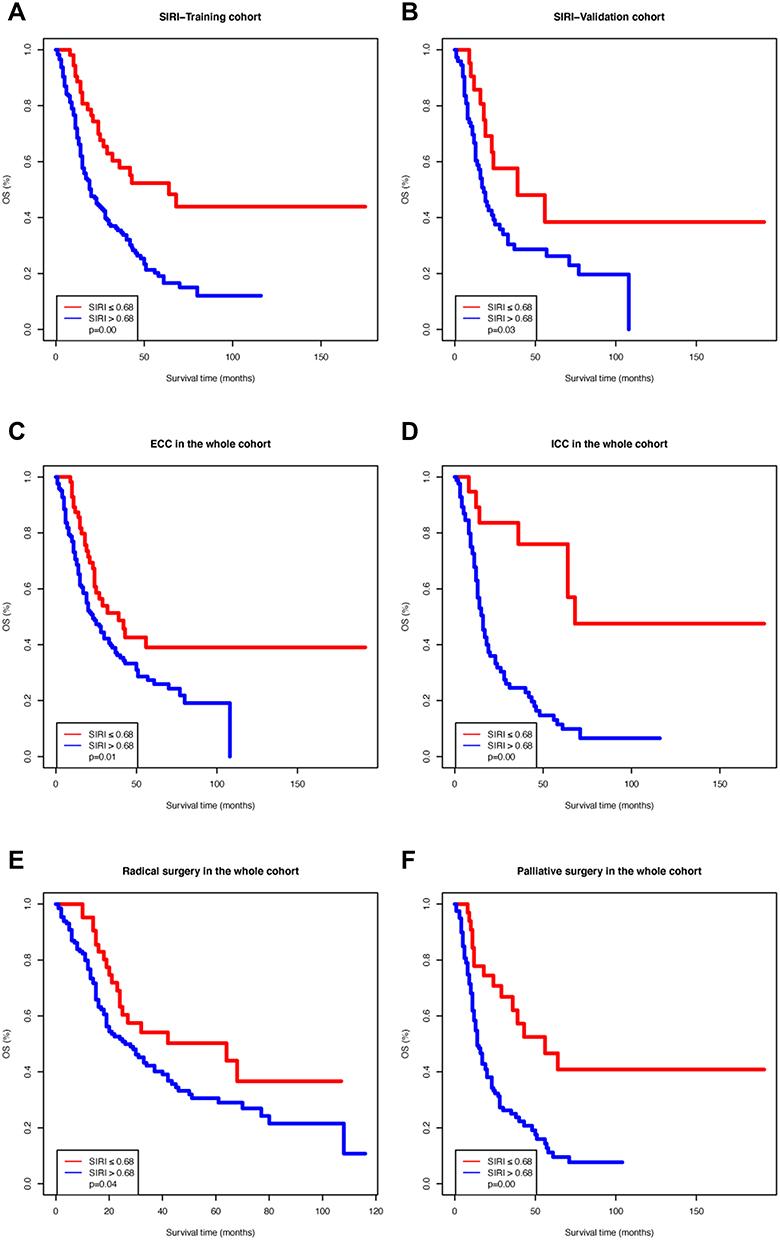
En la cohorte de entrenamiento, las curvas de OS Kaplan-Meier basadas en el SIRI mostraron diferencias significativas, lo cual fue confirmado por la prueba Log rank (
PAG
= 0,00;
Figura 1A
). El mismo resultado se observó en la cohorte de validación (
PAG
= 0,03;
Figura 1B
). Además, dividimos toda la cohorte según la ubicación del tumor (colangiocarcinoma extrahepático [CEC] o colangiocarcinoma intrahepático [CCI]) y el tipo de cirugía (radical o paliativa). Las curvas OS Kaplan-Meier según el SIRI en las subcohortes mencionadas anteriormente también mostraron diferencias significativas (
Figura 1C
-
F
). Luego, realizamos un análisis de riesgos proporcionales de Cox para la SG en la cohorte de entrenamiento (
Tabla 2
). En el análisis univariado, ictericia, CA19-9, γ-glutamil transpeptidasa (GGT), fosfatasa alcalina (ALP), LDH, albúmina (Alb), tamaño máximo del tumor, estadio N, estadio M, cirugía radical y todos los basados en inflamación. los biomarcadores se asociaron estadísticamente con la SG (p <0,1). Luego, el análisis multivariado mostró que la ictericia (índice de riesgo [HR]: 2,0980; intervalo de confianza [IC] del 95%: 1,1567–3,805;
PAG
= 0,015), SIRI alto (HR: 1,8892; IC del 95%: 1,0870–3,2836;
PAG
= 0,002), PLR (HR: 1,9085; IC del 95%: 1,1392–3,1972;
PAG
= 0,017), GGT (HR: 2,38; IC del 95%: 1,1313–5,0072;
PAG
= 0,022), tamaño máximo del tumor (HR: 2,5509; IC del 95%: 1,3096–4,969;
PAG
= 0,006), estadio N (HR: 1,8034; IC del 95%: 1,2337-2,6364;
PAG
= 0,002), estadio M (HR: 4,3937; IC del 95%: 1,1853-16,2874;
PAG
= 0,027) y cirugía radical (HR: 0,3675; IC 95%: 0,2558–0,528;
PAG
= 0,000) fueron factores independientes para predecir la SG.
Tabla 2
Análisis de riesgos proporcionales de Cox univariante y multivariante para la SG en la cohorte de entrenamiento
Figura 1
Curvas de supervivencia de Kaplan-Meier de diferentes grupos de índice de respuesta a la inflamación sistémica (SIRI). (
A
) Cohorte de formación; (
B
) Cohorte de validación; (
C
) Pacientes con colangiocarcinoma extrahepático; (
D
) Pacientes con colangiocarcinoma intrahepático; (
mi
) Pacientes que recibieron cirugía radical; (
F
) Pacientes sometidos a cirugía paliativa.
El establecimiento del modelo de predicción para SO
El modelo pronóstico de SG se estableció mediante variables obtenidas del análisis multivariado. Los factores clínico-patológicos de pronóstico incluyeron ocho factores de riesgo, incluidos SIRI, PLR, ictericia, GGT, tamaño máximo del tumor, estadio N, estadio M y cirugía radical. Las curvas de característica operativa del receptor (ROC) dependiente del tiempo del modelo de pronóstico que incluye los ocho factores de riesgo, el modelo de pronóstico que excluye SIRI y PLR, y el sistema de estadificación TNM se muestran en
Figura 2A
, que muestra que el modelo que integra los ocho factores fue mucho más confiable para predecir la SG que el sistema de estadificación TNM, con áreas de 1, 3 y 5 años bajo las curvas ROC (AUC) de 0,799, 0,802 y 0,867, respectivamente (AUC del sistema de estadificación TNM en 1, 3 y 5 años: 0,607, 0,593 y 0,602, respectivamente). El modelo que integra todos los factores también tuvo AUC mayores dentro del rango de tiempo completo que los del modelo sin SIRI y PLR. Además, las AUC de SIRI también fueron más altas que las de los otros biomarcadores basados en la inflamación, incluidos MLR, NLR y PLR (
Figura 2B
). Luego construimos un nomograma que contiene todos estos ocho factores para hacer que el modelo de pronóstico sea más visualizado y práctico, como se muestra en
figura 3
. Evaluamos la capacidad predictiva del modelo en la cohorte de entrenamiento utilizando el índice C, que fue de 0,737 (IC del 95%: 0,683–0,791), lo que indica una buena precisión de discriminación del nomograma. El índice C del sistema de estadificación TNM en la cohorte de entrenamiento fue 0,576 (IC del 95%: 0,515-0,637). Además, el rendimiento del nomograma se evaluó utilizando gráficos de calibración de 1, 3 y 5 años (
Figura 4A
,
C
y
mi
). Las líneas predichas y de referencia tuvieron un alto grado de coincidencia, lo que indica un buen desempeño del modelo (prueba de Hosmer-Lemeshow,
PAG
= 0,458, 0,813 y 0,205 para SG de 1, 3 y 5 años en la cohorte de entrenamiento, respectivamente).
Figura 2
Análisis de la característica operativa del receptor (ROC) dependiente del tiempo del modelo de pronóstico y el sistema de estadificación TNM (
A
) y biomarcadores basados en inflamación (
B
).
figura 3
Nomograma de pronóstico para predecir la probabilidad de supervivencia general a 1, 3 y 5 años según el grupo del índice de respuesta a la inflamación sistémica (SIRI), el grupo del índice plaquetas / linfocitos (PLR), el tamaño máximo del tumor, el estadio N, el estadio M , cirugía radical, ictericia y nivel de γ-glutamil transpeptidasa (GGT) en pacientes con colangiocarcinoma.
Figura 4
Gráfico de calibración de nomograma para predecir las probabilidades de supervivencia general en 1 (
A
y
B
), 3 (
C
y
D
) y 5 (
mi
y
F
) años en las cohortes de forma
ción y validación.Validación de la precisión predictiva del nomograma
En la cohorte de validación, el AUC del nomograma durante 1, 3 y 5 años fue 0,822, 0,784 y 0,842, respectivamente (el AUC correspondiente del sistema de estadificación TNM fue 0,566, 0,582 y 0,590, respectivamente). Además, el índice C del nomograma para la predicción de SG (0,738, IC del 95%: 0,679-0,797) fue significativamente más alto que el del sistema de estadificación TNM (0,523, IC del 95%: 0,465-0,581,
PAG
<0,05). Los gráficos de calibración de 1, 3 y 5 años (
Figura 4B
,
D
y
F
) para la probabilidad de SG también mostró una concordancia óptima entre la observación real y la predicción utilizando el modelo de pronóstico (prueba de Hosmer-Lemeshow,
PAG
= 0,322, 0,174 y 0,792 para SG de 1, 3 y 5 años en la cohorte de validación, respectivamente). Además, DCA para el modelo pronóstico y el sistema de estadificación TNM (
Figura 5
) mostró que nuestro modelo pronóstico era más beneficioso que todos o ninguno de los esquemas de muerte de los pacientes si la probabilidad umbral de un paciente era superior al 30%. Además, en esta gama, nuestro modelo aportó más beneficios que el sistema de estadificación TNM. Además, en comparación con el modelo sin SIRI y PLR, el modelo pronóstico que integra todos los factores también tuvo una utilidad clínica preferible, excepto para el DCA de 5 años en la cohorte de validación.
Figura 5
Análisis de la curva de decisión del modelo y sistema de estadificación TNM para 1- (
A
y
B
), 3- (
C
y
D
) y 5- (
mi
y
F
) años de supervivencia en las cohortes de formación y validación.
Comparación de la precisión predictiva para la SG entre el nomograma y el sistema de estadificación TNM
Basándonos en el modelo pronóstico desarrollado en este estudio, dividimos toda la cohorte en cuatro grupos con diferentes riesgos. Las curvas de OS Kaplan-Meier según el riesgo del modelo pronóstico mostraron diferencias significativas, lo que fue confirmado por la prueba Log rank (
PAG
= 0,00,
Figura 6A
). Además, la clasificación pronóstica del modelo fue incluso mejor que la del sistema de estadificación TNM (
Figura 6B
), con curvas más separadas y sin líneas de cruce en el rango de tiempo completo. Además, en pacientes con CEC o CCI, nuestro modelo también mostró un mejor rendimiento de predicción pronóstica que el del sistema de estadificación TNM (
Figura 6C
-
F
).
Figura 6
Curvas de supervivencia de Kaplan-Meier del sistema de estadificación Nomogram y TNM en el conjunto (
A
y
B
), ECC (
C
y
D
) y ICC (
mi
y
F
) cohortes.
Discusión
Se ha informado que la incidencia de colangiocarcinoma ha aumentado en los últimos años.
20
,
21
Aunque la cirugía radical sigue siendo la única opción curativa, muchos pacientes son diagnosticados en una etapa avanzada, perdiendo así la oportunidad de curación. Múltiples factores contribuyen al mal pronóstico actual, con tasas de supervivencia a 5 años muy bajas y tasas de mortalidad acumulada que aumentan en un 39%.
22
,
23
Por lo tanto, se necesita con urgencia una herramienta precisa para predecir el pronóstico de los pacientes con colangiocarcinoma en el entorno clínico para que los médicos puedan realizar un tratamiento individualizado y preciso. Aunque el sistema de estadificación TNM para el colangiocarcinoma sigue siendo el estándar de oro, las limitaciones como la mala discriminación entre pacientes con el mismo estadio TNM siguen sin resolverse.
Weinberg et al creían que la inflamación asociada a tumores juega un papel importante en la carcinogénesis y la progresión tumoral.
24
La evidencia acumulada ha demostrado que los biomarcadores basados en la inflamación sistémica, incluidos MLR, NLR y PLR, tienen funciones de pronóstico en varios tipos de tumores. Más específicamente, en el colangiocarcinoma, estudios previos han encontrado que NLR puede predecir la supervivencia de pacientes con cáncer de vías biliares avanzado que reciben quimioterapia paliativa.
10
Por el contrario, el PLR es un predictor independiente de SG en pacientes con ictericia obstructiva maligna recurrente.
11
En el presente estudio, SIRI, un biomarcador basado en inflamación, fue un factor pronóstico independiente en pacientes con colangiocarcinoma. Un valor de SIRI por encima de 0,68 indicó un pronóstico más precario en comparación con un valor de SIRI ≤0,68, y también se correlacionó con otras características clínico-patológicas deficientes como edad avanzada, LDH sérica elevada y mayor tasa de mortalidad. La investigación anterior que se centró en otros tipos de tumores sólidos, como el cáncer gástrico, esofágico y nasofaríngeo, tuvo resultados similares.
13-15
Sin embargo, el valor de corte óptimo de SIRI difirió entre los estudios, que fue de 1,2 en el cáncer de esófago y 1,8 en el cáncer de páncreas.
12
,
14
En el presente estudio, utilizamos 0,68 como valor de corte para estratificar a nuestros pacientes y validar su utilidad en la cohorte de validación; sin embargo, si este límite se aplica a todos los pacientes con colangiocarcinoma necesita una mayor validación interinstitucional externa. Mientras tanto, el análisis ROC basado en el tiempo mostró que SIRI tenía una mejor capacidad de pronóstico en la mayoría de los rangos de tiempo en comparación con otros biomarcadores basados en la inflamación, incluidos MLR, NLR y PLR. El análisis de regresión de Cox multivariante mostró que solo SIRI y PLR eran factores de pronóstico independientes entre todos los biomarcadores basados en la inflamación. Con base en estos hallazgos, establecimos un modelo de predicción innovador que integra el SIRI, PLR y otros factores, que demostró una excelente capacidad predictiva tanto en las cohortes de entrenamiento como de validación. Además, en comparación con el sistema de estadificación TNM, el modelo establecido en el estudio mostró una precisión predictiva mucho mejor con AUC mucho más altas en 1, 3 y 5 años, así como un índice C. Además, en comparación con el modelo que no integró el SIRI y el PLR, nuestro modelo tenía AUC más altas para el rango de tiempo completo. Nuestro modelo de predicción también mostró una mejor utilidad clínica, como lo muestra DCA. Además, las curvas de Kaplan-Meier de la clasificación de cuatro grupos basada en nuestro modelo tenían una mejor discriminación que el sistema de estadificación TNM tanto en la cohorte completa como en las cohortes ECC o ICC. Por tanto, SIRI mostró potencial como marcador para predecir el pronóstico de pacientes con colangiocarcinoma. Además, el modelo basado en el SIRI y otros factores tuvo un valor predictivo sobresaliente para los pacientes con colangiocarcinoma después de la resección quirúrgica. Tanto el SIRI como el modelo de predicción basado en él podrían aplicarse en el entorno clínico para desarrollar regímenes terapéuticos más precisos y personalizados. Hasta donde sabemos, este es el primer estudio que construye un nomograma que integra biomarcadores basados en la inflamación, incluyendo SIRI y otros factores clínico-patológicos, para predecir el pronóstico de los pacientes con colangiocarcinoma, que mostraron una mejor capacidad predictiva y utilidad clínica que los del modelo que no integró índices basados en la inflamación.
El mecanismo específico por el cual un SIRI alto predice un mal pronóstico en pacientes con colangiocarcinoma aún no está claro; Sin embargo, la evidencia acumulada ha indicado que los linfocitos circulantes desempeñan un papel importante en la defensa antitumoral al secretar varios tipos de citocinas, como el factor de necrosis tumoral alfa (TNF-α) y el interferón gamma (IFN-γ) para inducir la apoptosis de las células cancerosas. .
25
,
26
Por lo tanto, una disminución en el número y la calidad de los linfocitos podría resultar en el debilitamiento del sistema inmunológico y la defensa del tumor. Además, el recuento periférico de monocitos está asociado con el nivel de macrófagos asociados a tumores, lo que contribuye a la progresión del tumor y suprime la respuesta inmune antitumoral.
27
,
28
Asimismo, los neutrófilos circulantes pueden facilitar la angiogénesis tumoral al producir factor de crecimiento endotelial vascular.
29
Además, al secretar especies reactivas de oxígeno y óxido nítrico, los neutrófilos pueden prevenir la activación de los linfocitos T.
30
Por lo tanto, los neutrófilos periféricos pueden participar en la provisión de un microambiente tumoral favorable para promover el crecimiento, la invasión y la metástasis del tumor.
31
En conjunto, el SIRI combina los tres recuentos de células inmunitarias periféricas en un solo índice para hacer frente a interacciones complejas. La disminución de linfocitos y el aumento de monocitos o neutrófilos provocarán un SIRI elevado, lo que conducirá a un peor pronóstico para los pacientes con cáncer. Finalmente, debido a su conveniencia, naturaleza no invasiva, bajo precio y reproducibilidad, el SIRI se puede aplicar de manera rutinaria durante el período de seguimiento. Tanto el valor preoperatorio de SIRI como sus cambios dinámicos pueden servir como biomarcadores para la evaluación de la eficacia de la quimiorradioterapia adyuvante, la terapia inmunitaria o la terapia dirigida, y para la vigilancia de una posible recurrencia.
El presente estudio tiene las siguientes limitaciones. Primero, esta investigación solo estudió los biomarcadores basados en la inflamación antes de la resección quirúrgica; sin embargo, los cambios dinámicos del SIRI y otros factores durante el seguimiento también pueden correlacionarse con los resultados del paciente, lo que requiere una mayor investigación. En segundo lugar, se trata de un estudio retrospectivo de un solo centro, que puede haber provocado un sesgo potencial. Aunque los resultados se validaron en una cohorte de validación dividida aleatoriamente, se necesita una mayor validación externa antes de que nuestro modelo de pronóstico se pueda utilizar ampliamente. En tercer lugar, la inclusión de diferentes tipos de colangiocarcinoma podría amplificar la heterogeneidad de los pacientes. Aunque se han realizado análisis rigurosos de subgrupos para demostrar que la confiabilidad de los resultados no se vio comprometida obviamente por tal heterogeneidad, se necesitan investigaciones para confirmar los resultados aún más en ICC, colangiocarcinoma perihiliar y colangiocarcinoma distal, respectivamente. Además, aunque dividimos aleatoriamente la población general en una cohorte de entrenamiento y una cohorte de validación, algunas diferencias en las características iniciales entre las dos cohortes pueden causar un sesgo potencial.
Conclusión
En conclusión, SIRI fue un factor pronóstico independiente en pacientes con colangiocarcinoma. Este modelo de pronóstico que integra SIRI y otros factores clínico-patológicos mostró una buena precisión predictiva en la predicción de la probabilidad de supervivencia de los pacientes y fue mejor que el sistema de estadificación TNM. Puede convertirse en una herramienta confiable para que los médicos realicen evaluaciones personalizadas para pacientes con colangiocarcinoma.
Abreviaturas
SIRI, índice de respuesta a la inflamación sistémica; ROC, característica de funcionamiento del receptor; TMN, metástasis en ganglios tumorales; AJCC, Comité Conjunto Estadounidense sobre el Cáncer; MLR, proporción de monocitos a linfocitos; NLR, proporción de neutrófilos a linfocitos; PLR, relación plaquetas / linfocitos; PUMCH, Hospital de la Facultad de Medicina de la Unión de Pekín; SG: supervivencia global; CA 19-9, antígeno carbohidrato 19-9; CEA, antígeno carcinoembrionario; Índice C, índice de concordancia de Harrell; DCA, análisis de la curva de decisión; LDH, lactato deshidrogenasa; CEC, colangiocarcinoma extrahepático; ICC, colangiocarcinoma intrahepático; GGT, glutamil transpeptidasa (GGT); ALP, fosfatasa alcalina; Alb, albúmina; HR: índice de riesgo; IC: intervalo de confianza; AUC, área bajo la curva característica de funcionamiento del receptor; TNF-α, factor de necrosis tumoral alfa; IFN-γ, interferón-gamma.
Aprobación ética y consentimiento informado
Este estudio se realizó de acuerdo con los estándares éticos de la Declaración de Helsinki y ha sido aprobado por la Junta de Revisión Institucional del Hospital del Colegio Médico de la Unión de Pekín (Número: S-K1110). Escrito el consentimiento informado se obtuvo de todos los pacientes.
Expresiones de gratitud
Los autores desean agradecer al Dr. H. Nikki March y al Dr. Vikas Narang de Editage, por editar el texto en inglés de un borrador de este manuscrito.
Fondos
Este trabajo fue apoyado por subvenciones de la Fundación Nacional de Ciencias Naturales de China (número de subvención: 81972698), el Fondo de Innovación para Ciencias Médicas (CIFMS) de la Academia China de Ciencias Médicas (CAMS) (número de subvención: 2017-I2M-4-002) y Fundación Chen Xiao-Ping para el desarrollo de la ciencia y la tecnología de la provincia de Hubei (número de subvención: CXPJJH11900001-2019215).
Divulgación
Los autores declaran no tener ningún conflicto de intereses.
Referencias
1.
Tyson GL, El-Serag HB. Factores de riesgo de colangiocarcinoma.
Hepatologia
. 2011; 54: 173–184. doi: 10.1002 / hep.24351
2.
Rizvi S, Gores GJ. Patogenia, diagnóstico y tratamiento del colangiocarcinoma.
Gastroenterología
. 2013; 145: 1215–1229.
3.
Khan SA, Emadossadaty S, Ladep NG, et al. Tendencias al alza en el colangiocarcinoma: ¿nos engaña el sistema de clasificación de la CIE?
J Hepatol
. 2012; 56: 848–854. doi: 10.1016 / j.jhep.2011.11.015
4.
Raoof M, Singh G. Tendencias crecientes en la incidencia y mortalidad del colangiocarcinoma intrahepático: llegar a la causa raíz.
Surg Nutr hepatobiliar
. 2019; 8: 301–303. doi: 10.21037 / hbsn.2019.01.15
5.
Jarnagin WR, Fong Y, DeMatteo RP, et al. Estadificación, resecabilidad y resultado en 225 pacientes con colangiocarcinoma hiliar.
Ann Surg
. 2001; 234: 507. doi: 10.1097 / 00000658-200110000-00010
6.
de Jong MC, Marques H, Clary BM, et al. El impacto de la resección de la vena porta en los resultados del colangiocarcinoma hiliar: un análisis multiinstitucional de 305 casos.
Cáncer
. 2012; 118: 4737–4747. doi: 10.1002 / cncr.27492
7.
Rizvi S, Khan SA, Hallemeier CL, Kelley RK, Gores GJ. Colangiocarcinoma: conceptos en evolución y estrategias terapéuticas.
Nat Rev Clin Oncol
. 2018; 15: 95–111. doi: 10.1038 / nrclinonc.2017.157
8.
McLean L, Patel T. Variaciones raciales y étnicas en la epidemiología del colangiocarcinoma intrahepático en los Estados Unidos.
Int hígado
. 2006; 26: 1047–1053.
9.
Diakos CI, Charles KA, McMillan DC, Clarke SJ. Inflamación relacionada con el cáncer y efectividad del tratamiento.
Lancet Oncol
. 2014; 15: e493–503. doi: 10.1016 / S470-2045 (14) 70263-3
10.
Ha H, Nam AR, Bang JH y col. Soluble programmed death-ligand 1 (sPDL1) and neutrophil-to-lymphocyte ratio (NLR) predicts survival in advanced biliary tract cancer patients treated with palliative chemotherapy.
Oncotarget
. 2016;7:76604–76612. doi:10.18632/oncotarget.2810
11.
Jin H, Pang Q, Liu H, et al. Prognostic value of inflammation-based markers in patients with recurrent malignant obstructive jaundice treated by reimplantation of biliary metal stents: a retrospective observational study.
Medicamento
. 2017;96:e5895. doi:10.1097/MD.0000000000005895
12.
Qi Q, Zhuang L, Shen Y, et al. A novel systemic inflammation response index (SIRI) for predicting the survival of patients with pancreatic cancer after chemotherapy.
Cancer
. 2016;122:2158–2167. doi:10.1002/cncr.30057
13.
Li S, Lan X, Gao H, et al. Systemic Inflammation Response Index (SIRI), cancer stem cells and survival of localised gastric adenocarcinoma after curative resection.
J Cancer Res Clin Oncol
. 2017;143:2455–2468. doi:10.1007/s00432-017-2506-3
14.
Geng Y, Zhu D, Wu C, et al. A novel systemic inflammation response index (SIRI) for predicting postoperative survival of patients with esophageal squamous cell carcinoma.
Int Immunopharmacol
. 2018;65:503–510. doi:10.1016/j.intimp.2018.10.002
15.
Chen Y, Jiang W, Xi D, et al. Development and validation of nomogram based on SIRI for predicting the clinical outcome in patients with nasopharyngeal carcinomas.
J Investig Med
. 2019;67:691–698. doi:10.1136/jim-2018-000801
dieciséis.
World Medical Association. Declaration of Helsinki: ethical principles for medical research involving human subjects.
J Am Coll Dent
. 2014;81:14–18.
17.
Edge SB, Compton CC. The American Joint Committee on Cancer: the 7th edition of the AJCC cancer staging manual and the future of TNM.
Ann Surg Oncol
. 2010;17:1471–1474.
18.
Camp RL, Dolled-Filhart M, Rimm DL. X-tile: a new bio-informatics tool for biomarker assessment and outcome-based cut-point optimization.
Clin Cancer Res
. 2004;10:7252–7259. doi:10.1158/078-0432.CCR-04-713
19.
Vickers AJ, Elkin EB. Decision curve analysis: a novel method for evaluating prediction models.
Med Decis Making
. 2006;26:565–574. doi:10.1177/0272989X06295361
20.
Saha SK, Zhu AX, Fuchs CS, Brooks GA. Forty-Year Trends in Cholangiocarcinoma Incidence in the US: intrahepatic Disease on the Rise.
Oncologist
. 2016;21:594. doi:10.1634/theoncologist.2015-0446
21.
Yang JD, Kim B, Sanderson SO, et al. Biliary tract cancers in Olmsted County, Minnesota, 1976–2008.
Am J Gastroenterol
. 2012;107:1256–1262.
22.
Razumilava N, Gores GJ. Cholangiocarcinoma.
Lancet
. 2014;383:2168–2179. doi:10.1016/S0140-6736(13)61903-0
23.
Antwi SO, Patel T. Increasing mortality of intrahepatic cholangiocarcinoma in the US: are gender-specific risk factors important?
Hepatobiliary Surg Nutr
. 2019;8:635. doi:10.21037/hbsn.2019.10.10
24.
Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation.
Cell
. 2011;144:646–674. doi:10.1016/j.cell.2011.02.013
25.
Ferrone C, Dranoff G. Dual roles for immunity in gastrointestinal cancers.
J Clin Oncol
. 2010;28:4045–4051. doi:10.1200/JCO.2010.27.9992
26.
Rosenberg SA. Progress in human tumour immunology and immunotherapy.
Nature
. 2001;411:380–384. doi:10.1038/35077246
27.
Franklin RA, Liao W, Sarkar A, et al. The cellular and molecular origin of tumor-associated macrophages.
Science
. 2014;344:921–925. doi:10.1126/science.1252510
28.
Shibutani M, Maeda K, Nagahara H, et al. The peripheral monocyte count is associated with the density of tumor-associated macrophages in the tumor microenvironment of colorectal cancer: a retrospective study.
BMC Cancer
. 2017;17:404. doi:10.1186/s12885-017-3395-1
29.
Kusumanto YH, Dam WA, Hospers GA, Meijer C, Mulder NH. Platelets and granulocytes, in particular the neutrophils, form important compartments for circulating vascular endothelial growth factor.
Angiogenesis
. 2003;6:283–287. doi:10.1023/B:AGEN.0000029415.62384.ba
30.
Müller I, Munder M, Kropf P, Hänsch GM. Polymorphonuclear neutrophils and T lymphocytes: strange bedfellows or brothers in arms?
Trends Immunol
. 2009;30:522. doi:10.1016/j.it.2009.07.007
31.
Liu S, Li N, Yu X, et al. Expression of intercellular adhesion molecule 1 by hepatocellular carcinoma stem cells and circulating tumor cells.
Gastroenterology
. 2013;144:1031–41.e10.
This work is published and licensed by Dove Medical Press Limited. The full terms of this license are available at
https://www.dovepress.com/terms.php
and incorporate the
Creative Commons Attribution - Non Commercial (unported, v3.0) License
.By accessing the work you hereby accept the Terms. Non-commercial uses of the work are permitted without any further permission from Dove Medical Press Limited, provided the work is properly attributed. For permission for commercial use of this work, please see paragraphs 4.2 and 5 of
our Terms
.
Descargar Articulo
[PDF]




