Valentin Chioncel,
1,
& ast;
Catalina Liliana Andrei,
1,
& ast;
Radu Brezeanu,
1,
& ast;
Crina Sinescu,
1,
& ast;
Anamaria Avram,
1,
& ast;
Alin Laurentiu Tatu
2,
& ast;
1
Departamento de Patología Cardio-Torácica, Facultad de Medicina, Universidad de Medicina y Farmacia “Carol Davila”, Bucarest, 050474, Rumania;
2
Unidad de Investigación Médica y Farmacéutica / Plataforma Integrada de Investigación Competitiva e Interdisciplinaria “Dun & abreve; rea de Jos”, ReForm-UDJG, Centro de Investigación en el Campo de las Ciencias Médicas y Farmacéuticas, Facultad de Medicina y Farmacia, Departamento de Medicina Clínica, “Dun & abreve; rea de Jos ”Universidad de Galati, Galati, 800010, Rumania & ast; Estos autores contribuyeron igualmente a este trabajo Correspondencia: Valentin Chioncel Departamento de Patología Cardio-Torácica, Facultad de Medicina, Universidad de Medicina y Farmacia“ Carol Davila ”, Bucarest, 050474, Rumania
[correo electrónico protegido]
Abstracto:
El desarrollo de los stents coronarios ha supuesto una revolución en el tratamiento de la enfermedad coronaria. Más allá de sus muchas ventajas, los stents también tienen sus limitaciones y complicaciones. Las reacciones alérgicas a los stents coronarios son más frecuentes de lo que se reconoce. Estos pacientes con stent están expuestos a sustancias extrañas insertadas en contacto directo con la íntima coronaria. La hipersensibilidad a los componentes del stent y los fármacos recetados después de la inserción del stent, junto con cualquier exposición ambiental, parecen contribuir a estas reacciones adversas. Los pacientes pueden acudir al hospital con una amplia gama de síntomas y múltiples complicaciones, siendo las más importantes la reestenosis instent y la trombosis del stent. Aunque no son muy frecuentes (y no siempre son fáciles de identificar), se deben tener en cuenta las reacciones alérgicas tras los stents coronarios o periféricos. La selección cuidadosa de los pacientes (para el implante electivo de stents) en función de la propensión a las alergias, aunque difícil de conseguir, representa un factor clave para reducir el número de estas complicaciones.
Palabras clave:
stents, alergia, reestenosis, trombosis, síndrome de Kounis
Introducción
Las enfermedades cardiovasculares son trastornos que afectan al corazón o los vasos sanguíneos y se consideran la principal causa de morbilidad y mortalidad en todo el mundo.
1
Desde las primeras dilataciones con balón en 1977, la angioplastia coronaria se ha convertido en la principal terapia para la enfermedad coronaria.
2
Los principales inconvenientes que surgen de la angioplastia con balón (retroceso elástico del vaso y disecciones coronarias) han disminuido con la implantación de un stent. La primera implantación de un stent coronario en un ser humano en 1984 representó un gran paso adelante en el tratamiento de estos pacientes.
Más de 2 millones de stents se implantan anualmente en todo el mundo, la mayoría de ellos farmacológicamente activos.
3
Aunque este es un paso revolucionario en el tratamiento de pacientes coronarios, los stents, al igual que cualquier otra terapia, también son propensos a complicaciones o efectos secundarios.
Durante las intervenciones coronarias percutáneas (PCI), se coloca un stent coronario expandible dentro de la arteria culpable y la lesión arterial es una consecuencia inevitable de todos los procedimientos intervencionistas; esta lesión inicia una cascada de eventos celulares y moleculares.
Los stents suelen estar hechos de metal, siendo los más comunes el níquel, el cobalto y el cromo. Las reacciones alérgicas tanto cutáneas como extracutáneas, junto con la hipersensibilidad de tipo retardado debido a la exposición crónica a metales, son bien conocidas y están documentadas en la literatura (trombosis del stent, reestenosis del intestino, inflamación, dolor).
A pesar de los repetidos intentos e investigaciones para comprender mejor esta patología, aún no se ha descubierto la asociación entre la sensibilidad a los metales y la respuesta alérgica a los stents intravasculares.
Esta revisión puede proporcionar una actualización de la información actual en este dominio y puede ser muy útil para los médicos que se cruzan y tratan con pacientes con estas afecciones.
Temas principales
Las principales complicaciones de la implantación de un stent están representadas por la reestenosis instent y la trombosis del stent.
4
,
5
La reestenosis coronaria es la consecuencia de la hiperplasia de la íntima como respuesta a una lesión por balón / stent. Este fue un desafío importante que se redujo en gran medida tras la aparición de los stents impregnados con sustancias activas, los denominados stents liberadores de fármacos (DES). Los primeros estudios publicados con DES (RAVEL, SIRIUS) mostraron una tasa de reestenosis mucho menor en comparación con los stents de metal desnudo.
6
,
7
Posteriormente, numerosas investigaciones han confirmado las obvias ventajas del DES.
8-10
En la actualidad, la incidencia de reestenosis del intestino en todos los procedimientos coronarios invasivos es de alrededor del 10-15% y el tratamiento principal suele ser la inserción de otro stent o angioplastia con balón liberador de fármacos (DEBA).
11
La trombosis del stent es una complicación rara pero a veces crítica de la PCI que puede provocar un infarto de miocardio o la muerte.
12
La incidencia de trombosis del stent varía entre el 0,5% y el 2% y puede ocurrir a pesar de los avances recientes en la terapia y la técnica antiplaquetarias.
13-15
A veces se ha planteado la cuestión de si estas principales complicaciones (reestenosis y trombosis del stent) pueden estar relacionadas con alergias o hipersensibilidad a los materiales del stent. Por tanto, la investigación actual se centra en la seguridad de los stents coronarios.
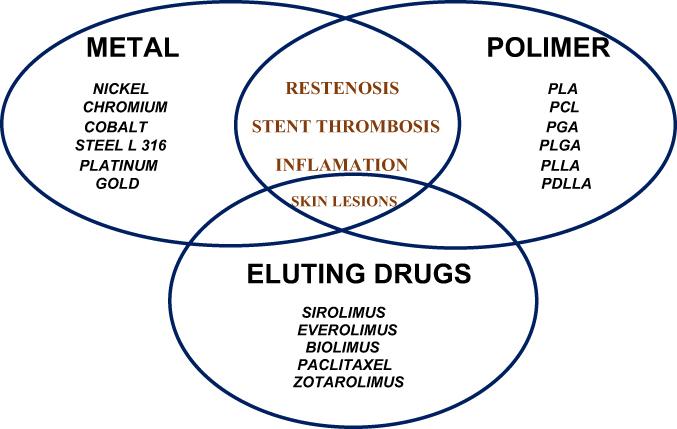
Las reacciones de hipersensibilidad al DES representan un desafío cada vez mayor y pueden ser el resultado de fármacos eluidos o metales intrínsecos y polímeros de stent; consulte
Figura 1
. A veces, pueden estar implicados medicamentos antiplaquetarios, por lo que la relación de causalidad no es muy fácil de establecer.
Figura 1
Efectos secundarios de hipersensibilidad de los stents.
Durante los últimos 30 años ha habido una preocupación creciente dentro de las comunidades médica y de pacientes sobre posibles reacciones alérgicas (hipersensibilidad) a materiales extraños implantados en el cuerpo.
Una de las cuestiones principales es si las reacciones de hipersensibilidad a los materiales de los stents de las arterias intracoronarias podrían estar asociadas con la reestenosis y la trombosis del instent.
Reestenosis de Instent
Los stents de metal desnudo están hechos de acero inoxidable, que es un acero con níquel y cromo agregados, siendo el níquel una de las causas más comunes de dermatitis alérgica por contacto. Los DES contienen, además de la estructura metálica, un recubrimiento de polímero (permanente o biodegradable) en el que se imprime el fármaco antiproliferativo.
Conceptualmente, cualquier componente del stent puede inducir trombosis o reestenosis inmunomediada en pacientes hipersensibles. Se han informado casos sobre esta respuesta perjudicial de los fármacos antiproliferativos y los recubrimientos poliméricos de los stents liberadores de fármacos,
dieciséis
pero sigue siendo incierto si los componentes metálicos del stent pueden inducir el fallo local del implante cuando se utilizan en pacientes con alergia al metal.
Se han publicado informes de casos de alergia al níquel desde 1980, con estimaciones de una incidencia general del 10% en la población general. Debido a que se piensa que la sensibilización al piercing es la causa en la mayoría de los casos, la incidencia en mujeres es mayor, entre el 14% y el 20%.
17
La mayoría de los casos notificados de alergia al níquel se manifiestan como una dermatitis de contacto común, pero los pacientes con implantes médicos que contienen níquel que desarrollan alergia al níquel suelen tener una respuesta sistémica más pronunciada, que con frecuencia incluye erupción eccematosa difusa sin respuesta a los corticosteroides o con mala respuesta.
Las reacciones cutáneas hipersensibles se describen con mayor frecuencia al níquel, pero también pueden presentarse signos o síntomas alérgicos en otros metales como el cobalto, el cromo, el molibdeno y el oro.
18
Desde 1995, los stents coronarios utilizados en todo el mundo se han diseñado con plataformas de acero inoxidable 316 L, aleación de cobalto-cromo o platino-cromo y, recientemente, cromato de platino (18-20%) y molibdeno (2,7-9,7%).
Después de la implantación de un stent que contiene níquel, el metal se libera de manera constante en la circulación sistémica, lo que promueve la expresión de la molécula de adhesión intercelular 1 (ICAM-1) en las células endoteliales, que desempeña un papel importante en el reclutamiento de células inflamatorias de el torrente sanguíneo.
19
En los casos alérgicos, la liberación de iones metálicos después del contacto con la piel induce una reacción de hipersensibilidad de tipo IV mediada por linfocitos T alérgenos específicos, que se manifiesta como una erupción pruriginosa roja con áreas de vesiculación y que desencadena una respuesta inmunológica excesiva.
20
,
21
A pesar de los avances tecnológicos masivos en la producción de stents, la reestenosis instent sigue siendo un problema clínico importante y los factores que predisponen a la reestenosis aún se desconocen en gran medida.
La reestenosis suele aparecer dentro de los 3 a 6 meses posteriores a la intervención, pero también puede ocurrir más tarde.
22-24
A menudo se define como la revascularización de la lesión diana y la incidencia en los stents tradicionales suele estar entre el 10 y el 30%.
24
,
25
Se ha sugerido que la alergia por contacto a los iones metálicos eluidos de los stents de acero inoxidable, principalmente níquel, cromato y molibdeno, es un factor que contribuye a la reestenosis instent.
26
En este sentido, algunos estudios clínicos han sugerido un mayor riesgo de reestenosis en pacientes que resultaron positivos en la prueba del parche para alergia al metal después de la colocación de un stent.
27
,
28
Sin embargo, los resultados de los estudios son contradictorios y aún no hay una conclusión firme en esta área.
A principios de la década de 2000, a pesar de los datos limitados, la Administración de Alimentos y Medicamentos advierte contra la implantación de stents en pacientes con antecedentes de alergia al metal e inició el proyecto Research on Adverse Drug / Device Events And Reports (RADAR) que revisa las asociaciones potencialmente causales entre agentes terapéuticos y efectos adversos. eventos.
29
En octubre de 2003, un aviso de la FDA describió 50 casos de hipersensibilidad después de la implantación de un stent CYPHER
30
con síntomas como sarpullido, disnea, urticaria, picazón y fiebre, pero un mes después (noviembre de 2003), un aviso de seguimiento indicó que casi todas las reacciones de hipersensibilidad fueron causadas por la terapia con medicamentos estándar asociada con la implantación de un stent.
31
Los investigadores del RADAR evaluaron todos los casos disponibles para detectar la posibilidad de que los componentes del DES puedan ser una causa de reacciones de hipersensibilidad y este fue el primer estudio que evaluó reacciones de tipo hipersensibilidad que ocurrieron después de la colocación del DES.
Dentro de las 2 semanas posteriores a la implantación del stent, el 85% de estos pacientes desarrollaron síntomas, como erupción cutánea (78%), picazón (27%), urticaria (23%), fiebre (13%) y anafilaxia (6%). Los síntomas persistieron> 30 días en el 50% de los pacientes y se clasificaron como graves en el 95% de los casos, el 34% requirió intervención urgente y el 18% hospitalización.
En solo 17 de 262 casos de casos de hipersensibilidad notificados a la FDA, el stent en sí parece ser la causa más probable de signos de hipersensibilidad.
De acuerdo con los criterios específicos de la OMS (que clasifican las asociaciones causales como ciertas, probables, posibles o improbables), solo un evento fue causado ciertamente por un DES, nueve probablemente fueron causados por DES y otros siete casos de hipersensibilidad probable o cierta causada por un DES se identificaron más tarde.
32
En dos casos, los signos de alergia ciertamente fueron causados por clopidogrel. En cuatro pacientes con hipersensibilidad focal, el examen necróptico encontró infiltrados eosinofílicos intensos y cicatrización deficiente de la íntima hasta 18 meses después de la implantación, posiblemente causada por DES.
El estudio RADAR concluyó que los componentes metálicos y no metálicos del DES podrían inducir hipersensibilidad. Con respecto a los fármacos impregnados en los stents, el sirolimus es una causa poco probable de hipersensibilidad porque típicamente reduce la infiltración eosinofílica y la liberación de histamina y se ha asociado con bajas tasas de hipersensibilidad.
33
pero se desconoce la incidencia de reacciones alérgicas al propio paclitaxel.
34
La matriz de polímero puede fragmentarse y exponer la estructura metálica,
35
aumentando la preocupación de que el níquel, el cromo y el molibdeno puedan inducir hipersensibilidad, por lo que el recubrimiento de polímero podría causar reacciones alérgicas tardías y persistentes.
36
En conclusión, los hallazgos del estudio sugieren que puede desarrollarse hipersensibilidad local y sistémica en respuesta a la implantación de DES en las arterias coronarias. Pero debido a que los ensayos clínicos con miles de pacientes no han informado un aumento de la mortalidad con DES en comparación con los stents convencionales,
37
,
38
Es probable que la incidencia de eventos de hipersensibilidad fatal debido al DES sea muy baja.
La relación entre la reacción alérgica al metal y el desarrollo de reestenosis instent en pacientes tratados con stents de acero inoxidable 316 L se ha investigado anteriormente. En general, estudios clínicos previos han sugerido una mayor propensión a la reestenosis recurrente en pacientes con hipersensibilidad al metal.
Köster y col.
26
mostró que una reacción de hipersensibilidad retardada al níquel y al molibdeno podría ser parte del proceso inflamatorio y uno de los factores desencadenantes de la reestenosis. Su grupo realizó pruebas de parche para detectar alergias a metales en 131 pacientes que se sometieron a angiografías repetidas por sospecha de reestenosis aproximadamente 6 meses después de la colocación de un stent de metal desnudo. De estos, se encontró que los 10 pacientes que tuvieron reacciones positivas al parche tenían reestenosis instent. Por el contrario, sólo 79 (65%) de los 121 pacientes restantes (que tenían parche negativo) tuvieron reestenosis. Por tanto, la diferencia estadísticamente significativa (p = 0,03) sugiere que la reacción alérgica al metal implantado fue un desencadenante de la reestenosis.
En el mismo patrón, Iijima et al.
27
encontraron que la prueba del parche positiva era un predictor significativo de reestenosis recurrente en pacientes tratados con stents de acero inoxidable 316 L (
pag
= 0,02).
Otra investigación de Aliağaoğlu et al
39
reclutó a 256 pacientes que habían recibido un stent coronario de cromo cobalto. La coronariografía y la prueba del parche se realizaron de forma independiente en 61 casos y se encontró reestenosis instent en 31 de ellos. Según los resultados de la prueba del parche, 7 de 31 pacientes (23%) del grupo de reestenosis tenían alergia por contacto al níquel, mientras que ninguno de los 30 pacientes (0%) del grupo de no reestenosis tenía alergia al níquel y se encontró que la diferencia era Estadísticamente significante (
pag
~ 0,006). Por lo tanto, los resultados del estudio mostraron una correlación entre la alergia al níquel y la reestenosis instent en pacientes tratados con stents de cromo cobalto.
Se planteó una preocupación específica con respecto a los stents dorados que parecían inducir hipersensibilidad sistémica o focal.
Svedman y col.
28
,
40
,
41
investigó cualquier posible relación entre la alergia por contacto al material del stent, especialmente el níquel y el oro, y la reestenosis de la arteria coronaria. Descubrieron que las tasas de reestenosis eran más altas en los pacientes alérgicos al oro que en los no alérgicos. Estos stents ya no se utilizan.
En otro estudio, Saito et al buscaron una correlación entre la positividad del parche y la reestenosis en pacientes con stent.
42
Por lo tanto, la positividad del parche fue significativamente más frecuente (p ~ 0.02) en un grupo con reestenosis recurrente (9/23) en comparación con el grupo sin recurrencia (5/42), lo que llevó a los autores a sugerir que la reacción tisular al componente metálico de 316 L, especialmente el níquel, puede desempeñar un papel importante en la reestenosis refractaria crónica.
Los stents coronarios no son los únicos que pueden determinar la hipersensibilidad. También existen casos de stents periféricos (hechos de Nitinol, con alto contenido de níquel) descritos en la literatura, que dieron lugar a reacciones alérgicas.
43
Se informaron algunos casos de alergia significativa al stent, que requirió la extracción del dispositivo médico que contiene níquel (lo cual puede ser factible o no).
En otro ejemplo, una mujer de 70 años desarrolló prurito generalizado y erupción cutánea, que apareció poco después de la implantación de un stent metálico ilíaco; la única forma de aliviar los síntomas era retirar el stent.
44
De manera similar, ha habido informes de síntomas sistémicos graves que ocurren después de la colocación de dispositivos metálicos de cierre del foramen oval permeable, síntomas que se resolvieron con la extracción del dispositivo.
45
En otro estudio en 47 pacientes que se sometieron al cierre del foramen oval permeable utilizando un dispositivo Amplatzer (50% de níquel), 5 pacientes (de los 8 identificados posteriormente como alérgicos al níquel mediante la prueba del parche) informaron un aumento en la frecuencia de migrañas, dolor de pecho y palpitaciones después de la colocación del dispositivo, significativamente más frecuentes que las informadas por sujetos de control no alérgicos.
46
Sin embargo, no hubo fallas del implante ni diferencias detectables en el rendimiento del dispositivo en el grupo de alergia en comparación con los sujetos de control.
Por otro lado, Norgaz et al no encontraron ninguna diferencia entre la alergia al níquel en pacientes con reestenosis frente a los casos sin reestenosis.
47
Por lo tanto, el estudio no apoyó la relación entre la alergia al níquel y el desarrollo de reestenosis en pacientes con stents de acero inoxidable.
Otro pequeño estudio de Dinamarca identificó a 17 pacientes a los que se les había colocado un stent en el pasado reciente y desarrollaron dermatitis como alergia al níquel o al cromo.
48
Solo 2 pacientes tuvieron que repetir la intervención coronaria, estadísticamente similar a los pacientes no alérgicos.
En el análisis de Slodownik se siguió a 99 pacientes: 70 pacientes tenían stents permeables en el segundo angiograma (grupo de stents permeables) y se encontró que 29 tenían reestenosis instent (grupo de reestenosis).
49
Se encontró que veintiocho (28,3%) pacientes tenían alergia a al menos un metal. No hubo diferencias significativas en la prevalencia de alergia al metal entre el grupo de stent permeable y el grupo de reestenosis (28,6 y 27,6%, respectivamente;
pag
= 0,921). Sus resultados no sustentan la teoría de que la alergia a los metales desempeña un papel en la patogenia de la reestenosis instent.
Otro estudio retrospectivo también sugiere que la implantación de un stent coronario en pacientes con antecedentes de alergia al metal no se asocia con resultados cardiovasculares adversos tempranos o tardíos. Romero-Brufau et al compararon a 29 pacientes alérgicos al metal que se sometieron a la implantación de un stent coronario con un grupo no alérgico (250 pacientes) emparejados por la demografía y la propensión a la alergia al metal.
50
No hubo diferencias en el número de segmentos tratados, los stents colocados y la frecuencia del uso de stents liberadores de fármacos. En cuanto a muerte intrahospitalaria, infarto de miocardio, mortalidad a 30 días e IM, mortalidad a 4 años, revascularización de la lesión diana (TLR) y muerte / IM / TLR, no se encontraron diferencias estadísticas.
Teniendo en cuenta todo esto, los resultados clínicos después de la colocación de un stent en pacientes con antecedentes de alergia al metal siguen sin estar claros y los mecanismos siguen sin comprenderse por completo.
Las reacciones de hipersensibilidad pueden ser causadas no solo por la matriz metálica del stent, sino también por el recubrimiento polimérico (en el caso del DES).
La estructura del DES incluye una matriz de polímero, que permite la administración de fármacos antiproliferativos para inhibir el crecimiento de las células del músculo liso vascular.
El DES de primera generación se basó en portadores de fármacos poliméricos bioestables, como poli (etileno-co-acetato de vinilo) (PEVA), poli (metacrilato de n-butilo) (PBMA) y poli (estireno-b-isobutileno-b-estireno). ) polímeros en bloque (SIBS). Se han notificado reacciones de hipersensibilidad.
51
,
52
y la persistencia de los recubrimientos poliméricos después de la liberación del fármaco, lo que provoca una mala reendotelización y favorece la trombosis tardía del stent.
53
Por tanto, el DES de segunda generación se desarrolló con polímeros biodegradables capaces de degradarse (en un período de 6 a 24 meses) una vez cumplida su función. Esto dio como resultado una disminución de la trombosis del stent tardía y muy tardía y también de reacciones de hipersensibilidad.
Los representantes típicos de los polímeros biodegradables (que se degradan fisiológicamente por hidrólisis) son los ácidos polihidroxicarboxílicos, como el poliglicólido (PGA), los polilactidos (PLA) y la policaprolactona (PCL). El PLA se ha probado intensamente como material de stent temporal en cardiología debido a su larga trayectoria de biocompatibilidad in vivo.
54
Algunos polímeros (considerados más biocompatibles), como el PLA sintético, necesitan años para degradarse y, por lo tanto, conllevan un riesgo de trombosis del stent tardía y muy tardía. Además, la PGA puede generar fragmentos que potencialmente conducen a émbolos.
55
Por lo tanto, los polímeros bioabsorbibles no están exentos de riesgos y son un trabajo en progreso.
56
Los DES de segunda y tercera generación utilizan polímeros biomiméticos (como fosforilcolina - PC, fluoruro de polivinilideno-hexafluoropropileno - PVDF-HFP, o el polímero BioLinx), que no interfieren con la reendotelización del stent.
57
Recientemente, los polímeros biodegradables (como PLA y polilactida-co-glicólido - PLGA) y DES sin polímero se estudiaron extensamente para optimizar su biocompatibilidad.
58
Sin embargo, varios estudios informan que los pacientes tratados con stents sin polímero muestran resultados clínicos similares a los tratados con DES de polímero duradero en términos de mortalidad, trombosis del stent y eficacia a largo plazo.
59
La idea de un armazón completamente biodegradable puede reducir los requisitos de una terapia antiplaquetaria dual a largo plazo y facilitar el retorno de la vasomoción de los vasos.
60
Los andamios clínicamente aprobados se basan principalmente en PLA (un polil-lactida - PLLA y un polid, L-lactida - PDLLA). Actualmente, existen algunos inconvenientes con respecto a las reacciones inflamatorias agresivas durante la erosión del polímero que conducen a una reestenosis instent.
61
Por lo tanto, las tareas futuras para el desarrollo de biomateriales utilizados para aplicaciones médicas no son solo adaptar diseños de stents, sino encontrar y promover biomateriales con propiedades antitrombóticas y antiinflamatorias.
Trombosis del stent / síndrome de Kounis
La trombosis del stent es una complicación dramática de la colocación de un stent coronario, que a menudo se presenta como un infarto agudo de miocardio o incluso una muerte súbita. Según el momento de implantación del stent, la trombosis del stent se puede clasificar como precoz (0 a 30 días después de la implantación del stent); tarde (> 30 días); muy tarde (> 12 meses). La trombosis tardía y muy tardía del stent se asocia con una variedad de causas, como una endotelización deficiente, inflamación, curación retardada, neoateroesclerosis y reacción de hipersensibilidad local.
62
Casos de trombosis del stent por alergia al stent
27
,
38
se han notificado incluso 2-3 años después de la implantación de la endoprótesis porque la sensibilización al níquel puede persistir durante muchos años.
63
La trombosis del stent es el resultado de la adhesión, activación y agregación en serie de plaquetas. La agregación plaquetaria es el resultado de la unión del receptor GP IIb / IIIa con el fibrinógeno y la interacción con el VWF. La trombina convierte el fibrinógeno en fibrina, que sirve como una matriz estable para la creación de trombos. Por lo tanto, los receptores para mediadores de hipersensibilidad también participan en la activación plaquetaria y estos mediadores se derivan de la unidad alérgica de eosinófilos y mastocitos.
64
Esto puede explicar por qué los pacientes pueden desarrollar trombosis del stent durante un episodio alérgico.
Por otro lado, la inflamación endotelial local (molécula de adhesión intercelular 1 que recluta células inflamatorias del torrente sanguíneo
sesenta y cinco
) y una respuesta inmune excesiva (una reacción de hipersensibilidad de tipo IV mediada por linfocitos T alérgenos específicos
15
) juegan un papel importante en la aparición de trombosis del stent.
La inflamación crónica y la disfunción endotelial inducen neoateroesclerosis a largo plazo dentro de los stents tanto metálicos como liberadores de fármacos, y la rotura de las placas neoateroescleróticas juega un papel importante en la aparición de t
rombosis del stent tardía, y especialmente muy tardía.66
Dado que la inflamación es una de las principales causas de trombosis del stent,
67
la administración sistémica de terapia antiinflamatoria o inmunosupresora (esteroides orales después de la ICP cuando se confirma una alergia a un metal), además de la terapia antiplaquetaria doble, podría ser beneficiosa para suprimir la inflamación vascular y reducir las tasas de trombosis del stent.
68–70
Konishi et al informaron de un caso con trombosis recurrente del stent en un paciente con alergia al stent demostrada que puede beneficiarse de la corticoterapia sistémica.
71
Además de la terapia antiplaquetaria, las dosis bajas de esteroides pueden conferir beneficios clínicos y reducir la incidencia de trombosis del stent debido a sus propiedades antiinflamatorias.
En un estudio post-mortem, se observaron infiltraciones eosinofílicas en el sitio del stent en pacientes con trombosis del stent asociada con alergias al stent.
51
,
72
Por lo tanto, los pacientes que desarrollen trombosis repetitiva del stent después de la implantación del stent deben someterse a una prueba de parche en busca de alergia al metal.
Estudios recientes han informado una baja incidencia de trombosis del stent después de la implantación de armazones vasculares biorreabsorbibles donde el riesgo se reduce notablemente después de la elución del fármaco antiproliferativo y la reabsorción del armazón. Esta evidencia puede ser muy importante en pacientes que presentan alergia al stent sometidos a PCI y que podrían beneficiarse de estos dispositivos.
73
Otra situación en la que la enfermedad coronaria interfiere con los procesos patógenos alérgicos es el síndrome de Kounis.
El síndrome de Kounis es un síndrome coronario agudo, secundario a una reacción alérgica. En estos casos, la liberación de citocinas puede precipitar un espasmo coronario, rotura de placa o trombosis del stent.
Se describen 3 tipos: el tipo III (alrededor del 5% de los casos de síndrome de Kounis) incluye pacientes con trombosis del stent de la arteria coronaria como resultado de una reacción alérgica, con presencia histológicamente demostrada de mastocitos y eosinófilos del trombo aspirado.
74
,
75
En la literatura se han descrito múltiples casos de síndrome de Kounis tipo III.
Tzanis et al describieron un caso curioso de trombosis precoz del stent (4 días después de la implantación) tras una reacción alérgica al consumo de alimentos en un hombre de 70 años.
76
En otro informe, Tripolino et al describieron el caso de un hombre de 47 años con trombosis aguda del stent, como consecuencia de una reacción alérgica a los medios de contraste.
77
Transcurridos 30 min desde el final de la angioplastia (colocación de stent LAD), el paciente presenta náuseas, sudoración, dolor torácico, prurito generalizado seguido de la aparición de eritema cutáneo. El ECG reveló una elevación significativa del segmento ST en V2-V5 y la angiografía coronaria inmediata mostró una trombosis completa del stent.
El tratamiento incluyó hidrocortisona, clorfeniramina, oxígeno, infusión salina y se repitió angioplastia con buen resultado.
Michas et al comunicaron un caso de infarto de miocardio con elevación del ST debido a trombosis del stent en el contexto de una reacción alérgica asociada con el consumo de hongos.
78
El síndrome de Kounis puede ser otro ejemplo del vínculo entre la implantación de un stent y las reacciones alérgicas, que a veces resultan en complicaciones graves como reestenosis y trombosis del stent; consulte
tabla 1
.
tabla 1
Estudios o informes de casos sobre los efectos secundarios de los stents
Se debe prestar especial atención a los pacientes con múltiples síndromes autoinmunes e implantación de stents.
79
En los pacientes diabéticos, la aterosclerosis es más persistente y agresiva que en los no diabéticos y el riesgo cardiovascular es particularmente alto; por lo tanto, los casos de cardiopatía isquémica y accidente cerebrovascular son más del doble en la población diabética que en la no diabética.
80
Ésta es la razón por la que el tratamiento de los pacientes diabéticos con enfermedad coronaria debe ser mucho más intensivo; Los stents liberadores de fármacos (SLF) suponen, por tanto, un gran paso adelante en el campo de las terapias intervencionistas en estos pacientes.
Sin embargo, tanto la trombosis del stent como la reestenosis instent son más comunes en pacientes con diabetes. La reestenosis después de la colocación de un stent, causada por hiperplasia de la neoíntima, sigue siendo una preocupación importante, especialmente para la población diabética. En un metanálisis de seis estudios, las tasas promedio de reestenosis entre los pacientes con diabetes fueron un 50% más altas que en los no diabéticos.
81
La diabetes también es un factor de riesgo importante para la trombosis del stent. En un estudio, la tasa de trombosis del stent fue 1,8 veces mayor en pacientes diabéticos que en pacientes no diabéticos (3,2% frente a 1,7%).
82
Estas son algunas de las razones por las que a menudo se prefiere el injerto de derivación de la arteria coronaria a la angioplastia en pacientes diabéticos. Sin embargo, no hay pruebas sólidas de un mayor riesgo de hipersensibilidad a los stents en pacientes diabéticos que en pacientes no diabéticos.
Por otro lado, los expertos no consideran que el riesgo de alergias secundarias al implante de stents sea un problema importante.
Morton Kern respondió con un triple NO a este problema de los stents coronarios. NO, no hago pruebas de alergia al níquel. NO, no trato a pacientes con alergia al níquel. Y, finalmente, NO, no elijo stents por miedo a la alergia.
83
El Dr. Greg Stone de la Universidad de Columbia, Nueva York, también comentó: "La mayoría de los estudios no han encontrado una relación firme entre la alergia al níquel y la reestenosis".
Entonces, a pesar de la evidencia teórica y los casos reportados sobre la relación entre el implante de stent y las reacciones alérgicas posteriores, actualmente no podemos conocer la magnitud de este problema.
A pesar de que es una terapia que salva vidas, los stents coronarios ocasionalmente pueden causar eventos adversos graves para esos pacientes. La matriz metálica, el recubrimiento polimérico, los fármacos eluidos, los antiplaquetarios y otros fármacos (que están tomando los pacientes con stent) actúan como un fuerte complejo antigénico capaz de inducir una reacción alérgica y algunas complicaciones como la reestenosis del intestino y la trombosis del stent.
84
,
85
Se necesitan nuevos ensayos sólidos y pautas basadas en evidencia para la evaluación de riesgos, las pruebas de diagnóstico y el tratamiento. Pueden ocurrir reacciones similares después de otros tipos de cirugía con o sin inoculación de materiales considerados no propios.
Conclusiones
Aunque la reestenosis y la trombosis del stent se consideran complicaciones multifactoriales, también se han incriminado variables procedimentales, clínicas y angiográficas.
Los especialistas deben educar a sus colegas sobre estas posibles complicaciones. Se debe interrogar a los pacientes sobre su historial alérgico y advertirles sobre el aumento de los riesgos antes de la colocación de stents intracoronarios.
Aunque hay voces que minimizan esta conexión, no se debe descuidar el problema.
Al menos en los pacientes con stent que padecen reestenosis recurrente o trombosis del stent, la hipersensibilidad a los componentes del stent probablemente juega un papel importante y debería ser una preocupación importante. Queda por demostrar si en estos casos la terapia antiinflamatoria o inmunosupresora (además de la medicación antiplaquetaria doble) puede ser útil para limitar estos efectos secundarios.
Declaración de intercambio de datos
Toda la información está documentada por referencias relevantes.
Contribuciones de autor
Todos los autores hicieron una contribución significativa al trabajo reportado, ya sea en la concepción, diseño del estudio, ejecución, adquisición de datos, análisis e interpretación, o en todas estas áreas; participó en la redacción, revisión o revisión crítica del artículo; dio la aprobación final de la versión que se publicará; han acordado la revista a la que se ha enviado el artículo; y acordó ser responsable de todos los aspectos del trabajo.
Fondos
No se recibió financiación.
Divulgación
Los autores declaran que no tienen intereses en competencia.
Referencias
1.
Krenning van Luyn GMJ, Harmsen MC. Neovascularización basada en células progenitoras endoteliales: implicaciones para la terapia.
Tendencias Mol Med
. 2009; 15 (4): 180–189.
2.
Liu T, Liu S, Zhang K, Chen J, Huang N.Endotelización de superficies de biomateriales cardiovasculares implantadas: el desarrollo de in vitro a in vivo.
J Biomed Mater Res A
. 2014; 102 (10): 3754–3772.
3.
Lee JH, Kim ED, Jun EJ, Yoo HS, Lee JW. Análisis de tendencias y perspectivas de los stents para vasos sanguíneos humanos.
Investigación de biomateriales
. 2018; 22: 8.
4.
Wenaweser P, Rey C, Eberli FR, et al. Trombosis del stent después de la implantación de un stent de metal desnudo: éxito de la intervención coronaria percutánea de emergencia y predictores de resultados adversos.
Eur Heart J
. 2005; 26 (12): 1180–1187.
5.
Windecker S, Meier B. Trombosis tardía del stent coronario.
Circulación
. 2007; 116 (17): 1952–1965.
6.
Morice MC, Serruys PW, Fajadet J, et al. Grupo de estudio RAVEL: estudio aleatorizado con el stent expansible con balón bx velocity recubierto de sirolimus en el tratamiento de pacientes con lesiones coronarias nativas de novo una comparación aleatoria de un stent liberador de sirolimus con un stent estándar para la revascularización coronaria.
N Engl J Med
. 2002;346(23):1773–1780.
7.
Moses J, Leon M, Popma J, et al. For the SIRIUS Investigators - Sirolimus-eluting stents versus standard stents in patients with stenosis in a native coronary artery.
N Engl J Med
. 2003;349:1315–1323.
8.
Mohan S, Dhall A. A comparative study of restenosis rates in bare metal and drug-eluting stents.
Int J Angiol
. 2010;19(2):e66–e72. doi:10.1055/s-0031-1278368,
9.
Auer J, Leitner A, Berent R, et al. Long-term outcomes following coronary drug-eluting- and bare-metal-stent implantation.
Atherosclerosis
. 2010;210(2):503–509. doi:10.1016/j.2010
10.
Buccheri D, Piraino D, Andolina G, Cortese B. Understanding and managing in-stent restenosis: a review of clinical data, from pathogenesis to treatment.
J Thorac Dis
. 2016;8(10):E1150–E1162. doi:10.21037/jtd.2016
11.
Mohananey D, Saucedo J, Stone GW, et al. Trends and outcomes of restenosis after coronary stent implantation in the United States.
J Am Coll Cardiol
. 2020;76(13):1521–1531.
12.
Mauri L, Hsieh WH, Massaro JM, Ho KK, D'Agostino R, Cutlip DE. Stent thrombosis in randomized clinical trials of drug-eluting stents.
N Engl J Med
. 2007;356:1020–1029.
13.
Jensen LO, Maeng M, Kaltoft A, et al. Stent thrombosis, myocardial infarction, and death after drug-eluting and bare-metal stent coronary interventions.
J Am Coll Cardiol
. 2007;50:463–470.
14.
Brener SJ, Cristea E, Kirtane AJ, et al. Intra-procedural stent thrombosis: a new risk factor for adverse outcomes in patients undergoing percutaneous coronary intervention for acute coronary syndromes.
JACC Cardiovasc Interv
. 2013;6(1):36–43.
15.
Généreux P, Stone GW, Harrington RA; CHAMPION PHOENIX Investigators, et al.. Impact of intraprocedural stent thrombosis during percutaneous coronary intervention: insights from the CHAMPION PHOENIX trial (Clinical trial comparing cangrelor to clopidogrel standard of care therapy in subjects who require percutaneous coronary intervention).
J Am Coll Cardiol
. 2014;63(7):619.
dieciséis.
Chen JP, Hou D, Pendyala L, Goudevenos JA, Kounis NG. Drug-eluting stent thrombosis: the Kounis hypersensitivity-associated acute coronary syndrome revisited.
J Am Coll Cardiol Cardiovasc Interv
. 2009;2:583–593.
17.
Basko-Plluska JL, Thyssen JP, Schalock PC. Cutaneous and systemic hypersensitivity reactions to metallic implants.
Dermatitis
. 2011;22:65–79.
18.
Nielsen NH, Linneberg A, Menne T, et al. Incidence of allergic contact sensitization in Danish adults between 1990 and 1998; the Copenhagen Allergy Study, Denmark.
Br J Dermatol
. 2002;147:487–492.
19.
Wataha JC, O'Dell NL, Singh BB, Whitford GM, Lockwood PE. Relating nickel-induced tissue inflammation to nickel release in vivo.
J Biomed Mater Res
. 2001;58:537–544.
20.
Thomas P, Summer B, Sander CA, Przybilla B, Thomas M, Naumann T. Intolerance of osteosynthesis material: evidence of dichromate contact allergy with concomitant oligoclonal T-cell infiltrate and TH1-type cytokine expression in the peri-implantar tissue.
Allergy
. 2000;55:969–972.
21.
Kornowski R, Hong MK, Tio FO, Bramwell O, Wu H, Leon MB. In-stent restenosis: contributions of inflammatory responses and arterial injury to neointimal hyperplasia.
J Am Coll Cardiol
. 1998;31:224–230.
22.
Beyar R. Novel approaches to reduce restenosis.
Ann NY Acad Sci
. 2004;1015:367–378.
23.
Radke PW, Kaiser A, Frost C, Sigwart H. Outcome after treatment of coronary in-stent restenosis: results from a systematic review using meta-analysis techniques.
Eur Heart J
. 2003;24:266–273.
24.
Cutlip DE, Chauhan MS, Baim DS, et al. Clinical restenosis after coronary stenting: perspectives from multicenter clinical trials.
J Am Coll Cardiol
. 2002;18:2082–2089.
25.
Schiele TM, Krotz F, Klauss V. Vascular restenosis striving for therapy.
Expert Opin Pharmacother
. 2004;5:2221–2232.
26.
Köster R, Vieluf D, Kiehn M, et al. Nickel and molybdenum contact allergies in patients with coronary in-stent restenosis.
Lanceta
. 2000;356:1895–1897.
27.
Iijima R, Ikari Y, Amiya E, et al. The impact of metallic allergy on stent implantation: metal allergy and recurrence of in-stent restenosis.
Int J Cardiol
. 2005;104:319–325.
28.
Svedman C, Ekqvist S, Moller H, et al. A correlation found between contact allergy to stent material and restenosis of the coronary arteries.
Contact Dermatitis
. 2009;60:158–164.
29.
Bennett CL, Nebeker JR, Lyons EA, et al. The Research on Adverse Drug Events and Reports (RADAR) project.
JAMA
. 2005;293:2131–2140.
30.
Information for Physicians on Sub-Acute Thromboses (SAT) and Hypersensitivity Reactions with Use of the Cordis CYPHER Coronary Stent.
FDA Public Health Web Notification
.
1er
ed. Rockville, MD: Food and Drug Administration; 2003.
31.
Updated Information for Physicians on Sub-acute Thromboses (SAT) and Hypersensitivity Reactions with Use of the Cordis CYPHER Sirolimus-eluting Coronary Stent.
FDA Public Health Web Notification
.
1er
ed. Rockville, MD: Food and Drug Administration; 2003.
32.
Nebeker JR, Barach P, Samore MH. Clarifying adverse drug events: a clinician's guide to terminology, documentation, and reporting.
Ann Intern Med
. 2004;140:795–801.
33.
Mosby's Drug Consult 2004 - The Comprehensive Reference for Generic and Brand Name Drugs
. St. Louis, MO: Elsevier Inc.; 2004.
34.
Rowinsky EK, Donehower RC. Paclitaxel (Taxol).
N Engl J Med
. 1995;332:1004–1014.
35.
Virmani R, Guagliumi G, Farb A, et al. Localized hypersensitivity and late coronary thrombosis secondary to a sirolimus-eluting stent: should we be cautious?
Circulation
. 2004;109:701–705.
36.
Hillen U, Haude M, Erbel R, Goos M. Evaluation of metal allergies in patients with coronary stents.
Contact Dermatitis
. 2002;47:353–356.
37.
Moses JW, Leon MB, Popma JJ, et al. Sirolimus-eluting stents versus standard stents in patients with stenosis in a native coronary artery.
N Engl J Med
. 2003;349:1315–1323.
38.
Stone GW, Ellis SG, Cox DA, et al. One-year clinical results with the slow-release, polymer-based, paclitaxel-eluting TAXUS stent: the TAXUS-IV trial.
Circulation
. 2004;109:1942–1947.
39.
Aliağaoğlu C, Turan H, Erden I, et al. Relation of nickel allergy with in-stent restenosis in patients treated with cobalt chromium stents.
Ann Dermatol
. 2012;24:4.
40.
Svedman C, Tillman C, Gustavsson CG, Moller H, Frennby B, Bruze M. Contact allergy to gold in patients with gold-plated intracoronary stents.
Contact Dermatitis
. 2005;52:192–196.
41.
Svedman C, Lundh T, Tillman C, Moller H, Gustavsson CG, Bruze M. Gold concentration in blood in patients with gold-plated stents.
Contact Dermatitis
. 2006;54:221–222.
42.
Saito T, Hokimoto S, Oshima S, Noda K, Kojyo Y, Matsunaga K. Metal allergic reaction in chronic refractory in-stent restenosis.
Cardiovasc Revasc Med
. 2009;10:17–22.
43.
Chioncel V, Brezeanu R, Sinescu C. New directions in the management of peripheral artery disease.
Am J Ther
. 2019;26(2):e284–e293.
44.
Guntani A, Kawakubo E, Ryosuke Yoshiga R, et al. Metallic allergy requiring removal of iliac stent: report of a case.
Surg Case Rep
. 2020;6:82.
45.
Khodaverdian RA, Jones KW. Metal allergy to Amplatzer occlude device presented as severe bronchospasm.
Ann Thorac Surg
. 2009;88:2021–2022.
46.
Slavin L, Tobis JM, Rangarajan K, Dao C, Krivokapich J, Liebeskind DS. Five-year experience with percutaneous closure of patent foramen ovale.
Am J Cardiol
. 2007;99:1316–1320.
47.
Norgaz T, Hobikoglu G, Serdar ZA, et al. Is there a link between nickel allergy and coronary stent restenosis?
Tohoku J Exp Med
. 2005;206:243–246.
48.
Thyssen JP, Engkilde K, Menne T, Johansen JD, Hansen PR, Gislason GH. No association between metal allergy and cardiac in-stent restenosis in patients with dermatitis-results from a linkage study.
Contact Dermatitis
. 2011;64:138–141.
49.
Slodownik C, Danenberg C, Merkin D, et al. Coronary stent restenosis and the association with allergy to metal content of 316L stainless steel.
Cardiovasc J Afr
. 2018;29:43–45.
50.
Romero-Brufau S, Best PJM, Holmes DR, et al. Outcomes after coronary stent implantation in patients with metal allergy.
Circ Cardiovasc Interv
. 2012;5:220–226.
51.
Virmani R, Kolodgie FD, Farb A. Drug-eluting stents: are they really safe?
Am Heart Hosp J
. 2004;2(2):85–88.
52.
Nebeker R, Virmani C, Bennett L, et al. Hypersensitivity cases associated with drug-eluting coronary stents: a review of available cases from the Research on Adverse Drug Events and Reports (RADAR) project.
J Am Coll Cardiol
. 2006;47(1):175–181.
53.
Farb A, Burke AP, Kolodgie FD, Virmani R. Pathological mechanisms of fatal late coronary stent thrombosis in humans.
Circulation
. 2003;108(14):1701–1706.
54.
van Alst M, Eenink MJD, Kruft MAB, Van Tuil R. ABC's of bioabsorption: application of lactide based polymers in fully resorbable cardiovascular stents.
EuroIntervention
. 2009;5:F23–F27.
55.
Ceonzo K, Gaynor A, Shaffe L, Kojima K, Vacanti CA, Stahl GL. Polyglycolic acid-induced inflammation: role of hydrolysis and resulting complement activation.
Tissue Eng
. 2006;12(2):301–308.
56.
Serruys PW, Kukreja N. Late stent thrombosis in drug eluting stents: return of the 'VB syndrome'.
Nat Clin Pract Cardiovasc Med
. 2006;3(12):637.
57.
Ong AT, Serruys PW. Technology insight: an overview of research in drug-eluting stents.
Nat Clin Pract Cardiovasc Med
. 2005;2(12):647–658.
58.
Patel MJ, Patel SS, Patel NS, Patel NM. Current status and future prospects of drug eluting stents for restenosis.
Acta Pharmaceutica
. 2012;62(4):473–496.
59.
Navarese EP, Kowalewski M, Cortese B, et al. Short and long term safety and efficacy of polymer-free vs. durable polymer drug-eluting stents.A comprehensive meta-analysis of randomized trials including 6178 patients.
Atherosclerosis
. 2014;233(1):224–231.
60.
Campos CM, Muramatsu T, Iqbal J, et al. Bioresorbable drug-eluting magnesium-alloy scaffold for treatment of coronary artery disease.
Int J Mol Sci
. 2013;14(12):24492–24500.
61.
Smith EJ, Jain AK, Rothman MT. New developments in coronary stent technology.
J Interv Cardiol
. 2006;19(6):493–499.
62.
Joner M, Finn AV, Farb A, et al. Pathology of drug-eluting stents in humans: delayed healing and late thrombotic risk.
J Am Coll Cardiol
. 2006;48:193–202.
63.
Nguyen SH, Dang TP, MacPherson C, Maibach H, Maibach HI. Prevalence of patch test results from 1970 to 2002 in a multi-centre population in North America (NACDG).
Contact Dermatitis
. 2008;58:101–106.
64.
Minai-Fleminger Y, Levi-Schaffer F. Mast cells and eosinophils: the two key effector cells in allergic inflammation.
Inflamm Res
. 2009;58:e631–e638.
sesenta y cinco.
Wataha JC, O'Dell NL, Singh BB, Ghazi M, Whitford GM, Lockwood PE. Relating nickel-induced tissue inflammation to nickel release in vivo.
J Biomed Mater Res
. 2001;58:537–544.
66.
Nakazawa G, Otsuka F, Nakano M, et al. The pathology of neoatherosclerosis in human coronary implants bare-metal and drug-eluting stents.
J Am Coll Cardiol
. 2011;57:1314–1322.
67.
Farb A, Sangiorgi G, Carter AJ, et al. Pathology of acute and chronic coronary stenting in humans.
Circulation
. 1999;99:44–52.
68.
Ribichini F, Tomai F, De Luca G, et al. Immunosuppressive therapy with oral prednisone to prevent restenosis after PCI. A multicenter randomized trial.
Am J Med
. 2011;124:434–443.
69.
Rhen T, Cidlowski JA. Antiinflammatory action of glucocorticoids–new mechanisms for old drugs.
N Engl J Med
. 2005;353:1711–1723.
70.
Chioncel V, Avram A, Sinescu C. A particular case of Wellens' syndrome.
Med Hypotheses
. 2020;144:110013.
71.
Konishi T, Yamamoto T, Funayama T, et al. Stent thrombosis caused by metal allergy complicated by protein S deficiency and heparin-induced thrombocytopenia: a case report and review of the literature.
Thromb J
. 2015;13:25.
72.
Tatu AL, Baroiu L, Fotea S, et al. A working hypothesis on vesicular lesions related to COVID-19 infection, Koebner Phenomena Type V, and a short review of related data.
Clin Cosmet Investig Dermatol
. 2021;14:419–423.
73.
Verheye S, Ormiston JA, Stewart J, et al. A next-generation bioresorbable coronary scaffold system: from bench to first clinical evaluation: 6- and 12-month clinical and multimodality imaging results.
JACC Cardiovasc Interv
. 2014;7:89–99.
74.
Sciatti E, Vizzardi E, Cani DS, et al. Kounis syndrome, a disease to know: case report and review of the literature.
Monaldi Arch Chest Dis
. 2018;88:898.
75.
Kounis NG. Coronary hypersensitivity disorder: the Kounis syndrome.
Clin Ther
. 2013;35:563–571.
76.
Tzanis G, Bonou M, Mikos N, et al. Early stent thrombosis secondary to food allergic reaction: kounis syndrome following rice pudding ingestion.
World J Cardiol
. 2017;9:283–288.
77.
Tripolino C, Tassone EJ, Morabito G, Grillo P, Missiroli B. Acute coronary stent thrombosis: a case of type 3 Kounis syndrome.
J Cardiol Cases
. 2019;19:33–35.
78.
Michas G, Stougiannos P, Thomopoulos T, et al. Acute anterior myocardial infarction due to stent thrombosis after mushroom consumption: a case of Kounis type III syndrome.
Hellenic J Cardiol
. 2017;58:378–380.
79.
Tatu AL, Ionescu MA. Multiple autoimmune syndrome type III - thyroiditis, vitiligo and alopecia areata.
Acta Endo (Buc)
. 2017;13(1):124–125.
80.
Seabra‐Gomes R. Percutaneous coronary interventions with drug eluting stents for diabetic patients.
Heart
. 2006;92(3):410–419.
81.
Gilbert J, Raboud J, Zinman B. Meta‐analysis of the effect of diabetes on restenosis rates among patients receiving coronary angioplasty stenting.
Diabetes Care
. 2004;27:990–994.
82.
Machecourt J, Danchin N, Lablanche JM, et al. Risk factors for stent thrombosis after implantation of sirolimus-eluting stents in diabetic and nondiabetic patients: the EVASTENT matched-cohort registry.
J Am Coll Cardiol
. 2007;50(6–7):501–508.
83.
Kern M. How should we manage nickel allergy in patients needing coronary stents?
Cathlabdigest
. 2011;19:1.
84.
Tatu AL, Elisei AM, Chioncel V, Miulescu M, Nwabudike LC. Immunologic adverse reactions of β-blockers and the skin.
Exp Ther Med
. 2019;18(2):955–959.
85.
Kounis NG, Mazarakis A, Tsigkas G. Giannopoulos S and Goudevenos J. Kounis syndrome: a new twist on an old disease.
Future Cardiol
. 2011;7:e805–e824.




